লিথিয়াম আয়ন ব্যাটারি কিভাবে কাজ করে
পাবলিক ডোমেনে উপলব্ধি হল যে সীসা অ্যাসিড ব্যাটারি পুরানো প্রযুক্তি। লিথিয়াম আয়ন ব্যাটারির একটি ভিন্ন উপলব্ধি রয়েছে, এটি আধুনিক, ক্লিনার, এটির শক্তির ঘনত্বের 3 বা 4 গুণ এবং দীর্ঘ চক্র জীবন রয়েছে। এই সবের সাথে, 150 বছরের পুরানো সীসা অ্যাসিড প্রযুক্তি টেবিলে কী কী সুবিধা আনতে পারে? আসলে, সবকিছু যেমন মনে হয় তেমন নয়, মার্কেটিং দাবিতে ব্যবহৃত ডেটার শিরোনামগুলির পিছনে দেখুন, তারপরে কিছুটা সাধারণ জ্ঞান, মৌলিক গবেষণা এবং কিছু প্রাথমিক বিজ্ঞান প্রয়োগ করুন। আপনি দেখতে পাবেন যে আসল ঘটনা বরং ভিন্ন।
প্রথম ভুল ধারণাটি ভলিউমেট্রিক এবং নির্দিষ্ট শক্তি ঘনত্বের সাথে সম্পর্কিত। 4 থেকে 5 গুণের শিরোনাম মানগুলি শুধুমাত্র নির্দিষ্ট শক্তির ঘনত্ব এবং সীমিত সংখ্যক লিথিয়াম আয়ন ব্যাটারি রসায়নের সাথে সম্পর্কিত, যার মধ্যে কিছু এখনও বাণিজ্যিক ব্যবহারে নেই। ডুমুর 2 লিথিয়াম আয়ন ব্যাটারি কোষগুলির জন্য বেশ কয়েকটি ক্যাথোডের তুলনা করে যেগুলি সবচেয়ে নিরাপদ Li-FePO4 রসায়নের জন্য প্রায় 100Wh/kg থেকে নিকেল-কোবল্ট-অ্যালুমিনিয়াম অক্সাইড ভেরিয়েন্টের জন্য 200Wh/kg পর্যন্ত। লিড অ্যাসিড ব্যাটারি ডায়াগ্রাম নীচে দেওয়া হল:


এই মানগুলি শুধুমাত্র একক-কোষ স্তরে প্রযোজ্য, প্যাক বা ইন-সার্ভিস অবস্থায় নয়। ডুমুর 3 কোষ এবং সিস্টেম স্তরে বিভিন্ন ব্যাটারি রসায়নের শক্তি ঘনত্ব দেখায়। লিথিয়াম আয়ন ব্যাটারি কোষগুলির শক্তি ঘনত্ব কার্যত অর্ধেক হয়ে যায় যখন সমস্ত সংযোগ, শীতলকরণ, নিরাপত্তা এবং ব্যাটারি পরিচালনার সরঞ্জামগুলির সাথে সম্পূর্ণরূপে ইনস্টল করা হয়।
নির্দিষ্ট শক্তির ঘনত্বের 3 থেকে 5 গুণ কোষের স্তরের সুবিধা 2 থেকে 3 গুণ কমে যায়। লিথিয়াম ক্যাথোড রসায়নের উপর নির্ভর করে আমরা কিছু অ্যাপ্লিকেশনে সম্পূর্ণরূপে ইনস্টল করা ব্যাটারি সিস্টেমের জন্য লিথিয়াম আয়ন ব্যাটারি এবং সীসা অ্যাসিড ব্যাটারির শক্তি ঘনত্বের মধ্যে সমতা দেখতে পাচ্ছি।
অন্য ফ্যাক্টর, চক্র জীবনের যে, এছাড়াও বিভ্রান্তির একটি উৎস. একটি লিথিয়াম আয়ন ব্যাটারি তার নেমপ্লেট রেটিং এর ক্ষমতা 80% এর নিচে নেমে যাওয়ার আগে কতটি চক্র সম্পাদন করতে পারে? দুই, তিন হাজার? সারণী 1 কর্মক্ষমতা এবং চক্র জীবনের জন্য বিভিন্ন লি-আয়ন ক্যাথোড উপকরণগুলির একটি সারাংশ দেয়।
লিড অ্যাসিড ব্যাটারি রসায়নের সুবিধা
ব্যাটারি একটি অদ্ভুত ডিভাইস। কেউ তাদের চায় না, কিন্তু প্রত্যেকেরই তাদের প্রয়োজন। প্রয়োজন হলেই কেনা হয়। কতজন লোক ব্যাটারির জন্য স্থানীয় মলে উইন্ডো শপে যাওয়ার পরিকল্পনা করে? এগুলি একটি ক্ষোভের ক্রয় এবং শুধুমাত্র যখন একেবারে প্রয়োজনীয় তখনই কেনা হয়৷ একজন ভালো সেলসম্যান আপনার কাছে টাকা থাকলে দুই জোড়া জুতা, দুটি গাড়ি এবং হয়তো দুটি বাড়ি বিক্রি করতে পারেন, কিন্তু তিনি আপনাকে দুটি SLI অটোমোবাইল ব্যাটারি বিক্রি করতে পারবেন না। আপনি যখন একটি ব্যাটারি কিনবেন তা একটি সোলার প্যানেলের জন্য একটি সৌর ব্যাটারি , একটি বৈদ্যুতিক বাইক বা একটি UPS এবং বৈদ্যুতিন সংকেতের মেরু বদল ব্যাটারি ব্যাকআপ সিস্টেম বা ফর্কলিফ্টের জন্য একটি ট্র্যাকশন ব্যাটারি কিনবেন না কি আপনি এটি সম্পর্কে আরও জানতে চান?
সীসা অ্যাসিড ব্যাটারি কীভাবে কাজ করে, প্রকার এবং মডেলের মধ্যে পার্থক্য কী এবং বিভিন্ন রসায়ন সম্পর্কে কীভাবে? তারা ব্যয়বহুল হতে পারে. একটি বাণিজ্যিক বা গার্হস্থ্য অ্যাপ্লিকেশনে পেব্যাক কী, একটি সীসা অ্যাসিড ব্যাটারি প্রতিস্থাপনের জীবন এবং খরচ কী? আপনার প্রয়োজনীয় আকার, উপলব্ধ স্থান, সীসা অ্যাসিড ব্যাটারির শক্তি দক্ষতা এবং রিচার্জের সময়? এবং তারপর, নিরাপত্তা, নিষ্পত্তি এবং কার্বন পদচিহ্নের লুকানো খরচ আছে। এই নিবন্ধটি লিথিয়াম আয়ন ব্যাটারির সাথে সীসা অ্যাসিড ব্যাটারির তুলনা করে এবং এই উভয় রসায়নের সাথে যুক্ত অনেক ভুল ধারণার সমাধান করে।
কোন লিথিয়াম আয়ন ব্যাটারি সবচেয়ে ভালো
| ক্যাথোড উপাদান | সংক্ষিপ্ত নাম | নামমাত্র ভোল্টেজ | নির্দিষ্ট শক্তি Wh/kg (সেল) | সাইকেল জীবন | মন্তব্য |
|---|---|---|---|---|---|
|
লিথিয়াম কোবাল্ট অক্সাইড (LiCoO2) |
এলসিও | 3.6 | 150-200 | 500-1000 | পোর্টেবল ডিভাইস - অতিরিক্ত চার্জে তাপীয় পলাতক |
| লিথিয়াম ম্যাঙ্গানিজ অক্সাইড (LiMn2O4) | এলএমও | 3.7 | 100-150 | 300-700 | পাওয়ার টুল, মেডিকেল ডিভাইস - এলসিওর চেয়ে নিরাপদ |
| লিথিয়াম নিকেল ম্যাঙ্গানিজ কোবাল্ট অক্সাইড (LiNiMnCO2) | এনএমসি | 3.6/3.7 | 150-220 | 1000-2000 | ই-বাইক, ইভি, শিল্প - উচ্চ সাইকেল জীবন |
| লিথিয়াম আয়রন ফসফেট (LiFePO4) | এলএফপি | 3.2 | 90-120 | 1000-2000 | ইভি, এসএলআই, অবসর - সমস্ত লিথিয়াম আয়ন ব্যাটারি রসায়নের মধ্যে সবচেয়ে নিরাপদ |
| লিথিয়াম নিকেল কোবাল্ট অ্যালুমিনিয়াম অক্সাইড (LiNiCoAlO2) | এনসিএ | 3.6 | 200-260 | 500 | ইন্ডাস্ট্রিয়াল, EV পাওয়ারট্রেন (টেসলা) TR 150C, CL 500 এ |
| লিথিয়াম টাইটানেট (Li4Ti5O12) | LTO | 2.4 | 50-80 | ইউপিএস, সোলার, ইভি পাওয়ারট্রেন (হোন্ডা, মিতসুবিশি)। CL 3000-7000 - খুব নিরাপদ |
দেখা যায়, সবগুলোই 800 থেকে 2000 চক্রের সীমার মধ্যে পড়ে। তুলনামূলকভাবে, একটি ভাল ডিজাইন করা লিড অ্যাসিড ব্যাটারি সহজেই 80% DOD থেকে 1600 এর বেশি চক্র অর্জন করতে পারে। মালিকানার খরচ বিবেচনা করার সময় কিভাবে এই সব যোগ করা হয়? এটি আমাদের পরবর্তী পয়েন্টে নিয়ে আসে যা হল সীসা-অ্যাসিড ব্যাটারির দাম। একটি লিড-অ্যাসিড ব্যাটারির তুলনায় একটি লিথিয়াম-আয়ন ব্যাটারির দাম কত? লিথিয়াম-আয়ন ব্যাটারি উৎপাদন প্ল্যান্ট খরচ? স্বাভাবিকভাবেই লিথিয়াম আয়ন ব্যাটারির দাম বেশি কিন্তু কত বেশি। আবার, এটি বিবেচনা করা স্তরের উপর নির্ভর করে। প্রেস রিলিজ আমাদের বলবে যে লি-আয়নের দাম কমছে এবং এখন সীসা অ্যাসিডের 2-3 গুণের মধ্যে রয়েছে।
সত্যিই? লিথিয়াম আয়ন ব্যাটারি এবং লিড অ্যাসিড ব্যাটারির জন্য 12V এবং 100 Ah এর বাণিজ্যিকভাবে উপলব্ধ অবসর ব্যাটারির দাম পেতে সাম্প্রতিক ইউকে ইন্টারনেট অনুসন্ধানে গড় দাম:
লিথিয়াম আয়ন ব্যাটারি $960 বা $800/kwh
লিড অ্যাসিড ব্যাটারি $215 বা $180/kwh
স্পষ্টতই, একই মান পেতে লিথিয়াম আয়ন ব্যাটারির আয়ু লিড অ্যাসিড ব্যাটারির সমতুল্য 4 গুণ হতে হবে। আমরা দেখেছি, এটি এমন নয়।


সব ক্ষেত্রেই, সীসা-অ্যাসিড ব্যাটারি নির্মাণ সবচেয়ে সাশ্রয়ী ছিল, এমনকি যখন একটি বৃহত্তর সীসা-অ্যাসিড ব্যাটারি আরো ভালো চার্জ গ্রহণযোগ্যতা এবং দীর্ঘ চক্র জীবন দিতে লাগানো হয়েছিল। এই উদাহরণে, অ্যাপ্লিকেশনটি ছিল ভারতের একটি টেলিকম টাওয়ার। একই নীতি বেশিরভাগ অ্যাপ্লিকেশন এবং ভৌগলিক ক্ষেত্রে সত্য ধারণ করে, আরও বেশি ঠান্ডা জলবায়ুতে। অন্য ভুল ধারণা হল লি-আয়ন একটি পরিষ্কার প্রযুক্তি এবং সীসা-অ্যাসিডের চেয়ে কম দূষণকারী। বিভিন্ন ব্যাটারি রসায়নের জন্য ক্র্যাডেল থেকে গেট নির্গমন ডুমুরে দেওয়া হয়েছে। 5 এবং 6।
এই চিত্রটি ব্যাটারি তৈরির জন্য অপারেশনের সীমানা দেখায়। কাঁচামালের নিষ্কাশন এবং পরিবহন থেকে শুরু করে সমস্ত প্রক্রিয়াকরণের ধাপের মাধ্যমে যেখানে ব্যাটারিগুলি পাঠানোর জন্য প্রস্তুত।
সারণী 2 হল একটি বাস্তব-জীবনের পরিস্থিতি যেখানে লিথিয়াম আয়ন ব্যাটারি এবং লিড অ্যাসিড ব্যাটারি বিভিন্ন জীবনকাল ধরে কাজ করার অর্থনীতির তুলনা করে।
| খরচ আইটেম | দৈনিক চলমান খরচ USD | দৈনিক চলমান খরচ USD |
|---|---|---|
| 3 বছর | সীসা অ্যাসিড ব্যাটারি | লিথিয়াম আয়ন ব্যাটারি |
| পরিমার্জন | 8.30 | 16.90 |
| ডিজেল (ডেলিভারি) | 15.50 | 15.50 |
| রক্ষণাবেক্ষণ | 2.46 | 2.46 |
| বিদ্যুৎ | 1.47 | 1.47 |
| ব্যাটারি চার্জ হইতেছে | 0.65 | 0.50 |
| মোট দিন/মাস | 28.38/851 | 36.83/1105 |
| 6 বছর | ||
| পরিমার্জন | 5.86 | 8.46 |
| ডিজেল | 15.50 | 15.50 |
| রক্ষণাবেক্ষণ | 2.46 | 2.46 |
| বিদ্যুৎ | 1.47 | 1.47 |
| ব্যাটারি চার্জ হইতেছে | 0.54 | 0.50 |
| মোট দিন/মাস | 25.83/775 | 28.39/852 |
Argonne ন্যাশনাল ল্যাবরেটরিজ থেকে এই তথ্য, দেখায় যে লিথিয়াম আয়ন ব্যাটারির জন্য কাঁচামাল নিষ্কাশন এবং পরিবহন সহ মোট উত্পাদন প্রক্রিয়া সীসা অ্যাসিড মান 4 গুণ বেশি। উপকরণ নিষ্কাশনের বিষয়ে, কোবাল্ট এবং ম্যাঙ্গানিজ এবং লিথিয়ামের মতো মৌলিক ক্যাথোড উপাদানগুলির সরবরাহ সম্পূর্ণরূপে নিশ্চিত নয়। নিষ্কাশন এবং পুনরুদ্ধারের প্রক্রিয়া বিদ্যমান কিন্তু খনি এবং উত্পাদন সাইটের সংখ্যা উল্লেখযোগ্যভাবে বৃদ্ধি পেলে সরবরাহ সীমিত করতে পারে। ভূ-রাজনৈতিক মানচিত্র এই উপকরণগুলির কিছু উত্সের জন্য অনিশ্চয়তার পূর্বাভাস দেয়।
লিথিয়াম আয়ন ব্যাটারি পুনর্ব্যবহারযোগ্য
এই রসায়নের পুনর্ব্যবহারযোগ্যতা এবং নিরাপত্তা গুরুত্বপূর্ণ কারণ। এটা জানা যায় যে সীসা অ্যাসিড ব্যাটারির প্রায় সমস্ত উপাদান 100% পুনর্ব্যবহৃত হয় যেখানে লিথিয়াম আয়ন ব্যাটারি পুনর্ব্যবহার করার জন্য কোনও বাণিজ্যিক প্রক্রিয়া নেই। এই পরিস্থিতিটি বোধগম্য হয় যখন আপনি বিবেচনা করেন যে Li, Co, Mn ইত্যাদির আরও ব্যয়বহুল উপাদানগুলি মোট লিথিয়াম আয়ন ব্যাটারির একটি ছোট ভগ্নাংশ। উদাহরণস্বরূপ, লিথিয়াম মোট কোষের ওজনের প্রায় 4%। এর সাথে সুস্পষ্ট সত্যটি যোগ করুন যে লিথিয়াম অত্যন্ত প্রতিক্রিয়াশীল (এর উচ্চ শক্তির ঘনত্বের ভিত্তি), যা বোধগম্যভাবে বর্জ্য থেকে নিষ্কাশন করা ব্যয়বহুল করে তোলে।
এর নির্মাণে বিভিন্ন উপকরণের সাথে জটিলতার অতিরিক্ত ফ্যাক্টর কারিগরি এবং অর্থনৈতিক উভয় দিক থেকেই পুনর্ব্যবহারকে কঠিন করে তোলে। ফলাফল? এই ব্যাটারি রিসাইকেল করার জন্য কোন বাণিজ্যিক প্রণোদনা নেই। এই কারণে, পুনর্ব্যবহার করার সুবিধাগুলি এখনও পাইলট পর্যায়ে রয়েছে এবং বেশিরভাগই সরকারী অর্থায়নে।
বর্তমানে, স্ক্র্যাপ করা লিথিয়াম আয়ন ব্যাটারির বেশিরভাগ অংশই তাদের পুনর্ব্যবহারে বাধ্য করার জন্য প্রযুক্তিগত অগ্রগতি বা আইনের অপেক্ষায় মজুত রয়েছে। যদি পরবর্তীটি বাস্তবায়িত করা হয় তাহলে একটি খরচ হবে, শেষ পর্যন্ত ভোগ করতে হবে। এটি লিড অ্যাসিড ব্যাটারির প্রকারের তুলনায় লি-আয়ন সেলের দাম আরও বাড়িয়ে দেবে।
লিথিয়াম আয়ন ব্যাটারি বিস্ফোরিত হতে পারে
অবশেষে, আমাদের নিরাপত্তা আছে। আমাদের জ্ঞানে কোনো লিড অ্যাসিড ব্যাটারি প্রয়োগের নিরাপত্তা প্রত্যাহার হয়নি কারণ আমরা জানি পোর্টেবল ইলেকট্রনিক ডিভাইস এবং এমনকি বৈদ্যুতিক যানবাহনে লি-আয়ন ব্যাটারির ক্ষেত্রে। ডুমুর 7 এই নিবন্ধটি লেখার সময় মাত্র কয়েক সপ্তাহ আগে যুক্তরাজ্যে একটি নতুন হাইব্রিড ভলভোর কী হয়েছিল তা দেখায়। এই ক্ষেত্রে এর লিথিয়াম আয়ন ব্যাটারি চার্জ করার সময় আগুন ধরে যায়।
লিথিয়াম-আয়ন ব্যাটারিতে আগুন
চিত্র 7 একটি ভলভো হাইব্রিড বৈদ্যুতিক গাড়িতে লি-আয়ন ব্যাটারির কারণে আগুন: এপ্রিল 2018-ইউকে বাসভবন


এই ভিডিওটি একটি লিথিয়াম ব্যাটারি দ্বারা সৃষ্ট একটি খুব সাম্প্রতিক আগুন দেখায়। সম্ভবত কোষে ভারসাম্যহীনতা এবং অনুপযুক্ত BMS এর কারণে।
এমনকি লিথিয়াম আয়ন ব্যাটারি সংরক্ষণ বা পরিবহন করার সময় গুরুতরভাবে বিপজ্জনক আগুনের কারণ হয়েছে। যদিও এই অনুষ্ঠানগুলি বিরল, সেগুলিকে স্বীকার করতে হবে এবং উপযুক্ত সুরক্ষা সরঞ্জাম এবং ব্যাটারি পরিচালনা সফ্টওয়্যার ইনস্টল করতে হবে৷ উদাহরণস্বরূপ নিউ ইয়র্ক ফায়ার ডিপার্টমেন্ট লিথিয়াম আয়ন ব্যাটারির আগুন কীভাবে মোকাবেলা করা যায় তা এখনও সিদ্ধান্ত নেওয়ার প্রক্রিয়ার মধ্যে রয়েছে। এটি দৃঢ়ভাবে সুপারিশ করবে যে বিশ্বব্যাপী লিথিয়াম আয়ন ব্যাটারির জন্য বিদ্যমান নিরাপত্তা ব্যবস্থা পর্যালোচনা করা প্রয়োজন।
নিউইয়র্ক ফায়ার ডিপার্টমেন্টের দৃষ্টিভঙ্গি নিম্নরূপ:
সংবাদ নিবন্ধের উদ্ধৃতি: AWS ইউটিলিটি ড্রাইভ নভেম্বর 15, 2016 “আগুন সবচেয়ে বড় সমস্যা নয়,” রজার্স বলেছেন। অগ্নিনির্বাপকদের আগুন মোকাবেলা করার জন্য প্রশিক্ষিত করা হয়, তবে তাদের জানা দরকার যে তারা কী মোকাবেলা করছে। লি-আয়ন ব্যাটারি বিষাক্ত অ্যাসিড এবং দাহ্য বাষ্প নির্গত করতে পারে। এই বাষ্পগুলির মধ্যে কিছু আগুন দ্বারা গ্রাস করা হয়, কিন্তু যদি সেগুলি না হয়, তবে সেগুলি জ্বলতে পারে বা অগ্নিনির্বাপকদের জন্য সমস্যা হতে পারে। সবচেয়ে বড় সমস্যা হল “পোস্ট-অপ” যা ঘটে তা হল আগুন নিভে যাওয়ার পরে৷ এমনকি যদি একটি ব্যাটারি বন্ধ করা হয় তবে এটি 72 ঘন্টা পর্যন্ত পুনরায় জ্বলতে পারে, রজার্স বলেছিলেন। -লে. নিউ ইয়র্কের বিপজ্জনক উপকরণ অপারেশন বিভাগের পল রজার্স ফায়ার বিভাগ”
লিথিয়াম আয়ন ব্যাটারি নাকি লিড অ্যাসিড ব্যাটারি?
লিথিয়াম আয়ন ব্যাটারির অবশ্যই সীসা অ্যাসিডের চেয়ে ভাল কর্মক্ষমতা বৈশিষ্ট্য রয়েছে। যাইহোক, নিরাপত্তা এবং ব্যবস্থাপনার প্রয়োজনীয়তার সাথে যুক্ত অতিরিক্ত হার্ডওয়্যার দ্বারা এই সুবিধাগুলি গুরুতরভাবে হ্রাস পেয়েছে। নেট ফলাফল হল যে সীসা অ্যাসিড ব্যাটারির স্বতন্ত্র সুবিধা রয়েছে, বিশেষ করে যখন ওজন বা চার্জ গ্রহণযোগ্যতা দ্বারা সীমাবদ্ধ নয় এমন অ্যাপ্লিকেশন বিবেচনা করা হয়। সীসা অ্যাসিড ব্যাটারি উত্পাদন উদ্ভিদ খরচ কম প্রাথমিক খরচ; কম ক্রয় মূল্য এবং সীসা অ্যাসিডের কম পরিশোধের খরচ কম পরিবেশগত প্রভাব এবং অন্তর্নিহিত নিরাপত্তার সাথে মিলিত, নিম্নলিখিত সুবিধাগুলি প্রদান করে:
- কম ক্রয় মূল্য. দাম লি-আয়ন সমতুল্যের প্রায় এক-চতুর্থাংশ। কম অপারেটিং খরচ বেশিরভাগ অ্যাপ্লিকেশনের মালিকানার মোট খরচ কম দিতে।
- পুনর্ব্যবহারযোগ্যতা। সমস্ত সীসা অ্যাসিড ব্যাটারি সামগ্রীর প্রায় 100% পুনর্ব্যবহৃত হয়। স্ক্র্যাপ মান ব্যাটারি উপাদান খরচের 20% পর্যন্ত অতিরিক্ত রাজস্ব প্রদান করতে পারে। লিথিয়াম ব্যাটারি পুনর্ব্যবহার করার জন্য কোন অবকাঠামো বা বাণিজ্যিক প্রক্রিয়া নেই
- নিরাপত্তা সীসা অ্যাসিডের রসায়ন লিথিয়াম আয়ন ব্যাটারির তুলনায় সহজাতভাবে নিরাপদ
- স্থায়িত্ব। সীসা অ্যাসিড সরবরাহের অনেকগুলি সুপ্রতিষ্ঠিত উত্স রয়েছে, বিশেষত পুনর্ব্যবহারযোগ্য সুবিধাগুলি থেকে। রাজনৈতিকভাবে সংবেদনশীল এলাকা থেকে লিথিয়াম এবং অন্যান্য ক্যাথোড সামগ্রী সরবরাহ করা হতে পারে। বর্তমান বৈশ্বিক উপকরণ নিষ্কাশন এবং উত্পাদন ক্ষমতা উভয়ই লিথিয়াম আয়ন ব্যাটারির উৎপাদনে দ্রুত বৃদ্ধিকে সমর্থন করবে না।
- কার্বন পদচিহ্ন। সীসা অ্যাসিড ব্যাটারি উত্পাদন লিথিয়াম আয়ন ব্যাটারির এক তৃতীয়াংশ কার্বন ফুটপ্রিন্ট গেট করার জন্য একটি দোলনা আছে।
লিথিয়াম আয়ন ব্যাটারি কোম্পানির আঁকা ছবি থেকে একটি ভিন্ন ছবি। যদিও এটি তর্ক করা যায় না যে সীসা অ্যাসিডের শক্তির ঘনত্বের একটি অসুবিধা রয়েছে, বাস্তবতা হল সীসা-অ্যাসিড ব্যাটারি এখনও একটি অত্যন্ত নিরাপদ, প্রতিযোগিতামূলক এবং অনেক অ্যাপ্লিকেশনে ব্যাটারি প্রযুক্তির সেরা পছন্দ।
লিথিয়াম আয়ন ব্যাটারি কি?
ক্যাথোড এবং অ্যানোড উপকরণ: যদিও নিকেল-মেটাল হাইড্রাইড (Ni-MH) কোষগুলি 1990-এর দশকে প্রাথমিকভাবে পছন্দ করা হয়েছিল, বিশ্বের প্রথম বাণিজ্যিক লিথিয়াম আয়ন রিচার্জেবল ব্যাটারি পণ্যটি 1991 সালে সনি কর্পোরেশন দ্বারা প্রকাশিত হয়েছিল। ভর এবং ভলিউম উভয় দ্বারা উচ্চ শক্তি সামগ্রী ছাড়াও, এই ব্যাটারিটি চমৎকার নিম্ন-তাপমাত্রার বৈশিষ্ট্য, লোড বৈশিষ্ট্য এবং চক্র বৈশিষ্ট্যগুলিও প্রদান করে। ফলস্বরূপ, এটি দ্রুত বাজার দখল করে এবং অডিও এবং ভিডিও সরঞ্জাম, ব্যক্তিগত কম্পিউটার, বহনযোগ্য টেলিফোন এবং অন্যান্য বহনযোগ্য সরঞ্জামগুলির জন্য শক্তির একটি অপরিহার্য উত্স হয়ে ওঠে।
আজকের উন্নত ব্যাটারি প্রযুক্তি ফোর্ড মোটর কোং ল্যাবরেটরিতে কুমার এবং সহকর্মীদের দ্বারা সোডিয়াম β-অ্যালুমিনা নামক কঠিন ফেজ NaAl 11 O 17 -এর উচ্চ আয়নিক পরিবাহিতা আবিষ্কারের মাধ্যমে শুরু হয়েছিল। [১. ওলোফ রামস্টোমস্ট্রোম, রসায়নে নোবেল পুরস্কারে, রসায়নে নোবেল পুরস্কারের বৈজ্ঞানিক পটভূমি 2019; 2. YFY Yao এবং JT Kummer, J. Inorg. নিউক্ল. কেম। 29, 2453 (1967)]।
এটি উপলব্ধির দিকে পরিচালিত করে যে কঠিন পদার্থে আয়নিক পরিবহন আসলে খুব দ্রুত হতে পারে এবং এটি বিভিন্ন নতুন প্রযুক্তির দিকে নিয়ে যেতে পারে। এর কিছুক্ষণ পরে, ফোর্ডের গবেষকরা দেখিয়েছিলেন যে কেউ একটি সম্পূর্ণ নতুন ধরণের ব্যাটারি তৈরি করতে একটি উচ্চ পরিবাহী কঠিন ইলেক্ট্রোলাইট ব্যবহার করতে পারে, নেতিবাচক ইলেক্ট্রোডে গলিত সোডিয়াম এবং ধনাত্মক ইলেক্ট্রোড হিসাবে সালফারের গলিত সোডিয়ামের দ্রবণ ব্যবহার করে, সোডিয়াম-পরিবাহী এর মধ্যে কঠিন ইলেক্ট্রোলাইট [N. ওয়েবার এবং জেটি কুমার, প্রক. বার্ষিক শক্তি উৎস কনফ. 21, 37 (1967)]।
যেমনটি প্রত্যাশিত হতে পারে, শীঘ্রই সাদৃশ্যপূর্ণ লিথিয়াম সিস্টেমের সম্ভাবনার বিষয়ে বিবেচনা করা হয়েছিল, কারণ এটি স্বীকৃত ছিল যে অন্যথায় সমতুল্য লিথিয়াম কোষ একটি সোডিয়াম কোষের চেয়ে উচ্চ ভোল্টেজ তৈরি করবে। উপরন্তু, লিথিয়াম সোডিয়াম তুলনায় কম ওজন আছে, আরেকটি সুবিধা।
মৌলিক লিথিয়াম ব্যবহার করা যায়নি, কারণ এর গলনাঙ্ক কম। পরিবর্তে, কঠিন লিথিয়াম ধাতুগুলি, প্রাথমিকভাবে Li/Si এবং Li/Al সিস্টেমগুলি, তদন্ত করা হয়েছিল [ RA Huggins, J. Power Sources 81–82, 13 (1999)]।
সেই সময়ে ইতিবাচক ইলেক্ট্রোড রিঅ্যাক্ট্যান্ট হিসাবে বেশ কয়েকটি উপাদান তদন্ত করা হয়েছিল, যার মধ্যে সবচেয়ে বেশি মনোযোগ দেওয়া হয়েছিল FeS বা FeS 2 ব্যবহার করার জন্য। লিথিয়ামের সাথে প্রতিক্রিয়ার পরে, এই উপাদানগুলির পুনর্গঠন প্রতিক্রিয়া হয়, প্রাথমিক পর্যায়গুলি অদৃশ্য হয়ে যায় এবং নতুনগুলি তৈরি হয় [DR Vissers, Z. Tomczuk এবং RK Steunenberg, J. Electrochem. সমাজ 121, 665 (1974)]।
লিথিয়াম আয়ন ব্যাটারি কবে আবিষ্কৃত হয়?
প্রফেসর হুইটিংহাম এই ধরনের উপকরণে ইলেক্ট্রোকেমিক্যাল ইন্টারক্যালেশন অন্বেষণ করেন এবং 1973 সালে ব্যাটারিতে ইলেক্ট্রোডের মতো এই ধরনের উপকরণের প্রস্তাব করেন। এই কাজের ফলে 1976 সালে একটি কার্যকরী, রিচার্জেবল ব্যাটারি তৈরি হয়েছিল। সফল কোষটি অ্যানোড হিসাবে লিথিয়াম ধাতু এবং ক্যাথোড হিসাবে টাইটানিয়াম সালফাইড (TiS 2 ) এবং দ্রাবক হিসাবে প্রোপিলিন কার্বনেটে (PC) ইলেক্ট্রোলাইট হিসাবে লিথিয়াম হেক্সাফ্লুরোফসফেট ( LiPF 6 ) দ্বারা গঠিত। এই প্রতিশ্রুতিশীল অধ্যয়নগুলি হুইটিংহামকে ব্যাটারির ইলেক্ট্রোডের মতো উপাদানগুলিতে বৈদ্যুতিন রাসায়নিক আন্তঃকরণ অন্বেষণ করতে অনুপ্রাণিত করেছিল। একটি কার্যকরী, রিচার্জেবল ব্যাটারি পরবর্তীতে 1976 সালে প্রদর্শিত হয়েছিল
[(ক) হুইটিংহাম, ট্রানজিশন-মেটাল ডিসালফাইডসে এমএস ইলেক্ট্রোইন্টারকেলেশন। জে কেম। Soc., Chem. কমুন 1974, 328–329।] (এক্সন রিসার্চ অ্যান্ড ইঞ্জিনিয়ারিং কোম্পানির সাথে)।
(খ) হুইটিংহাম, এমএস ব্যাটারি এবং বেস ডি চ্যালকোগেনার্স। বেলজিয়ান পেটেন্ট নং 819672, 1975।
(গ) হুইটিংহাম, এমএস ইলেকট্রিক্যাল এনার্জি স্টোরেজ এবং ইন্টারক্যালেশন কেমিস্ট্রি। বিজ্ঞান 1976, 192 (4244), 1126–1127।
কিন্তু সাফল্য ছিল স্বল্পস্থায়ী। বারবার সাইকেল চালানোর সময়, ধাতব লিথিয়াম সাইকেল চালানোর সময় ধাতব পৃষ্ঠে ডেনড্রাইট তৈরি করে, যার ফলে শর্ট-সার্কিট হয়।
এই সমস্যাটি বিকল্প সমাধানের জন্য একটি নতুন অনুসন্ধান এবং একটি “আয়ন ট্রান্সফার সেল” কনফিগারেশন (যাকে “রকিং চেয়ার”ও বলা হয়) কোষের জন্য অনুপ্রেরণা দেয়, যেখানে উভয় ইলেক্ট্রোড আয়নগুলিকে মিটমাট করতে পারে প্রস্তাবিত হয়েছিল।
যদি একটি ইতিবাচক ইলেক্ট্রোড উপাদানে প্রাথমিকভাবে লিথিয়াম থাকে এবং প্রথম চার্জ করার সময় কিছু বা সমস্ত লিথিয়াম অপসারণ করা হয়, তবে কোষটি সম্ভাব্য বিকাশ করে। অতএব, ইতিবাচক ইলেক্ট্রোড উপাদানগুলি থাকা সম্ভব যা প্রায় 3V এর উপরে সম্ভাব্যতায় লিথিয়ামের সাথে প্রতিক্রিয়া করে, যদি তারা ইতিমধ্যেই লিথিয়াম ধারণ করে এবং এই লিথিয়ামটি ইলেক্ট্রো-রাসায়নিকভাবে নিষ্কাশন করা যেতে পারে।
লিথিয়াম আয়ন ব্যাটারি কে আবিস্কার করেন?
লিথিয়াম ইতিমধ্যেই উপস্থিত রয়েছে এমন উপাদানগুলির ব্যবহার জড়িত এই পদ্ধতিটি প্রথম প্রফেসর গুডেনাফ দ্বারা প্রদর্শিত হয়েছিল। প্রাথমিকভাবে লিথিয়াম ধারণকারী উপকরণের প্রথম উদাহরণ, এবং ইলেক্ট্রোকেমিক্যালি লিথিয়াম মুছে ফেলার জন্য, 1980 সালে Li1−xCoO2 এর কাজ।
[কে. মিজুশিমা, পিসি জোন্স, পিজে উইজম্যান এবং জেবি গুডেনাফ, মেটার। Res. ষাঁড়. 15, 783 (1980)] এবং Li1−xNiO2
[JB Goodenough, K. Mizushima এবং T. Takada, Jpn. জে অ্যাপল শারীরিক 19 (সরবরাহ 19-3), 305 (1980)]
অ্যানোডের বিকাশের সমান্তরালে, ধাতব লিথিয়ামের চেয়ে উচ্চ সম্ভাবনার অ্যানোডগুলির সাথে একত্রে উচ্চতর কোষের ইএমএফ অর্জনের জন্য আরও ভাল ক্যাথোড সামগ্রীর সন্ধান করা হয়েছিল। 1979/1980 সালে একটি অগ্রগতি আসে যখন জন বি. গুডনেফ এবং অক্সফোর্ডে তার সহকর্মীরা
ইউনিভার্সিটি, ইউকে, আবিষ্কার করেছে যে LixCoO2, MX2 ধরনের আরেকটি ইন্টারক্যালেটেড ধাতব চ্যালকোজেনাইড, ক্যাথোড উপাদান হিসাবে কাজ করতে পারে।
[গুডনফ, জেবি; মিজুশিমা, কে. ফাস্ট আয়ন কন্ডাক্টর। মার্কিন পেটেন্ট নং 4,357,215, 1982]।
[মিজুশিমা, কে.; জোন্স, পিসি; উইজম্যান, পিজে; Goodenough, JB LixCoO2 (0<x<-1): একটি নতুন
উচ্চ শক্তির ঘনত্বের ব্যাটারির জন্য ক্যাথোড উপাদান। মেটার Res. ষাঁড়. 1980, 15 (6), 783-789]।
উপাদানের গঠন লি-এর অনুরূপ ছিলx টিআইএস2 কোবাল্ট ডাই অক্সাইড (CoO2 ) স্তর যেখানে লিথিয়াম আয়নগুলি অনেক জালির প্রসারণ ছাড়াই আবদ্ধ হতে পারে। Goodenough যুক্তি যে যখন MX এ X2 হল একটি ছোট ইলেক্ট্রোনেগেটিভ উপাদান, ফলে ক্যাটেশন গ্রহণ প্রক্রিয়া একটি বড় নেতিবাচক মুক্ত-শক্তি পরিবর্তন এবং একটি উচ্চ সেল ভোল্টেজ (ΔG = -nFE) এর সাথে যুক্ত হবে। একটি X অক্সিজেনের সাথে, পরিস্থিতিটিকে বিশেষভাবে প্রতিশ্রুতিশীল বলে মনে করা হয়েছিল, এছাড়াও লিথিয়াম আয়নগুলিকে ক্লোজ-প্যাকড অক্সিজেন অ্যারেগুলিতে পর্যাপ্ত পরিমাণে মোবাইল হওয়ার প্রস্তাব দেওয়া হয়েছিল।
যুক্তিটি সঠিক বলে প্রমাণিত হয়েছে, এবং CoO2 উপাদান Li+/Li-এর সাপেক্ষে ~4 থেকে 5 V এর খুব উচ্চ সম্ভাবনা দেখায়। ইলেক্ট্রোকেমিক্যাল অধ্যয়নগুলি এই ক্ষেত্রে প্রোপিলিন কার্বনেটে লিথিয়াম টেট্রাফ্লুরোবোরেট (LiBF4) দ্বারা গঠিত একটি ইলেক্ট্রোলাইট দিয়ে করা হয়েছিল।
এই আবিষ্কারটি লিথিয়াম ধাতুর তুলনায় উচ্চ সম্ভাবনার সাথে অ্যানোড উপাদানগুলির ব্যবহারকে সক্ষম করে, উপযুক্ত কার্বোনাসিয়াস পদার্থের অনুসন্ধানকে আরও বাড়িয়ে তোলে। গ্রাফাইটের ইলেক্ট্রোকেমিক্যাল ইন্টারক্যালেশনের সমস্যা সমাধানের অসুবিধা বিবেচনা করে, পরিবর্তে অন্যান্য বিকল্পগুলি তদন্ত করা হয়েছিল।
লিথিয়াম আয়ন ব্যাটারি কোথায় আবিষ্কৃত হয়?
1985 সালে একটি অগ্রগতি আসে যখন আকিরা ইয়োশিনো (আসাহি কাসেই কর্পোরেশনের) নেতৃত্বে একটি জাপানি দল বাষ্প-ফেজ-গ্রোর্ন কার্বন ফাইবার (ভিজিসিএফ) এবং পরে তাপ-চিকিত্সা করা পেট্রোলিয়াম কোক আবিষ্কার করে। পরবর্তী উপাদানটি স্ফটিক (গ্রাফিটিক) এবং অ-ক্রিস্টালাইন ডোমেনের মিশ্রণ ধারণ করে বলে পরিচিত ছিল এবং গবেষকরা বিশেষভাবে স্থিতিশীল, তবুও উচ্চ-কার্যকারি, স্ফটিকতার নির্দিষ্ট ডিগ্রি সহ গুণগুলি সনাক্ত করতে পারেন।
[আকিরা ইয়োশিনো, লি-আয়ন ব্যাটারির জন্ম, অ্যাঞ্জেওয়ান্ডতে প্রবন্ধ, অ্যাঞ্জেউ।, কেম। int. এড., 2012 , 51, 5798-5800]
এই কার্যকর অ্যানোড উপাদানগুলির সাহায্যে, ইয়োশিনো আয়ন স্থানান্তর সেল কনফিগারেশনের উপর ভিত্তি করে একটি দক্ষ, কার্যকরী লিথিয়াম-আয়ন ব্যাটারি তৈরি করেছে। শনাক্ত করা কার্বোনাসিয়াস উপাদানটি এইভাবে একটি অ্যানোড হিসাবে ব্যবহৃত হয়েছিল এবং ক্যাথোড হিসাবে Goodenough’s LixCoO2 উপাদান (সাধারণত অল্প পরিমাণে টিন থাকে) ব্যবহার করা হয়েছিল। পলিথিন বা পলিপ্রোপিলিন দ্বারা গঠিত বিভাজক স্তরগুলি ব্যবহার করা হয়েছিল এবং ইলেক্ট্রোলাইটটি প্রোপিলিন কার্বনেটে (পিসি) লিথিয়াম পারক্লোরেট (LiClO4) দ্বারা গঠিত ছিল।
ইয়োশিনোও 1986 সালে ব্যাটারির উপর ওজন কমিয়ে এই ব্যাটারির নিরাপত্তা প্রমাণ করেছিলেন। কোন আগুন বা বিস্ফোরণ ঘটেনি যেখানে লিথিয়াম ধাতব অ্যানোড ব্যবহার করে ব্যাটারিগুলি হিংসাত্মক প্রতিক্রিয়া দেখায়।

চিত্র 8. 1986 সালে ইয়োশিনো তার লি-আয়ন ব্যাটারি দিয়ে প্রথম নিরাপত্তা পরীক্ষা করে।
ক) যে মুহূর্তে একটি লোহার পিণ্ড ব্যাটারির সঙ্গে ধাক্কা খায়
বি) সংঘর্ষের পর প্রোটোটাইপ লি-আয়ন ব্যাটারি
গ) ধাতব লি অ্যানোড ব্যাটারি সংঘর্ষের পরে
[ক্রেডিট: আকিরা ইয়োশিনো, লি-আয়ন ব্যাটারির জন্ম, অ্যাঞ্জেওয়ান্ডতে প্রবন্ধ, অ্যাঞ্জেউ।, কেম। int. এড., 2012, 51, 5798-5800]
এই আবিষ্কার এবং উন্নয়নগুলি শেষ পর্যন্ত একটি বাণিজ্যিক লিথিয়াম ব্যাটারি প্রকাশের দিকে পরিচালিত করে
1991 সালে। আরও উন্নয়নের সাথে, লি-আয়ন ব্যাটারিটি 1991 সালে সনি এবং 1992 সালে আসাহি কাসেই এবং তোশিবার যৌথ উদ্যোগে বাণিজ্যিকীকরণ করা হয়েছিল।
[নিশি, ওয়াই, লিথিয়াম আয়ন সেকেন্ডারি ব্যাটারির বিকাশ। কেম। Rec. 2001, 1, 406-413]
ব্যাটারিটি একটি পেট্রোলিয়াম কোক-ভিত্তিক অ্যানোড উপাদান, ক্যাথোড হিসাবে LixCoO2 এবং প্রোপিলিন কার্বনেটে (PC) লিথিয়াম হেক্সাফ্লুরোফসফেট (LiPF6) দ্বারা গঠিত একটি জল-মুক্ত ইলেক্ট্রোলাইটের উপর ভিত্তি করে তৈরি করা হয়েছিল। চার্জিং ভোল্টেজ উচ্চ ছিল (4.1 V পর্যন্ত), রেকর্ডকৃত নির্দিষ্ট শক্তি ~80 Wh/kg এবং শক্তির ঘনত্ব ~200 Wh/ লিটার।
সেই সময়ে বাজারে থাকা অন্যান্য ব্যাটারির তুলনায়, লিথিয়াম ব্যাটারি দ্রুত খুব প্রতিযোগিতামূলক হয়ে ওঠে এবং মূলত আসন্ন মোবাইল বিপ্লবের পথ প্রশস্ত করে।
প্রায় একই সময়ে, এটি পাওয়া গেছে যে গ্রাফাইট আসলে একটি উপযুক্ত ইলেক্ট্রোলাইট সংমিশ্রণে ব্যবহার করা যেতে পারে। [ফং আর, স্যাকেন ইউ ভন, ডন জেআর, স্টাডিজ অফ লিথিয়াম ইন্টারক্যালেশন ইন কার্বনস ইউজিং অনাকুয়াস ইলেক্ট্রোকেমিক্যাল সেল। জে ইলেক্ট্রোকেম। সমাজ 1990, 137 (7), 2009-2013]
ইথিলিন কার্বনেটযুক্ত দ্রাবক ব্যবহার করে, যা এখন পর্যন্ত উচ্চতর গলনাঙ্কের কারণে উপেক্ষা করা হয়েছে, চার্জ/ডিসচার্জ চক্রের সময় গ্রাফাইট ইলেক্ট্রোডের পৃষ্ঠে একটি কঠিন ইলেক্ট্রোলাইট ইন্টারফেজ (SEI) গঠিত হয়েছিল, যার ফলে কার্বন উপাদানকে এক্সফোলিয়েশন এবং আরও পচন থেকে রক্ষা করে। . [পেলেড, ই. ন্যাকিয়াস ব্যাটারি সিস্টেমে ক্ষার এবং ক্ষারীয় আর্থ ধাতুর বৈদ্যুতিক রাসায়নিক আচরণ, সলিড ইলেক্ট্রোলাইট ইন্টারফেস মডেল। জে ইলেক্ট্রোকেম। সমাজ 1979, 126 (12), 2047-2051।
এই আবিষ্কারটি ব্যাটারি সম্প্রদায়ের দ্বারা দ্রুত গৃহীত হয়েছিল, এবং গ্রাফাইটের উপর ভিত্তি করে একটি পরবর্তী প্রজন্মের লিথিয়াম-আয়ন ব্যাটারি যেমন অ্যানোড উপাদান তৈরি হয়েছিল। এই অ্যানোড উপাদানের সাথে, 4.2 V এর চার্জিং ভোল্টেজ সহ ব্যাটারিগুলি খুব শীঘ্রই উত্পাদিত হয়েছিল, যার ফলে শক্তির ঘনত্ব ~400 Wh/litre হয়৷
লিথিয়াম-আয়ন ব্যাটারির বিকাশ এই গুরুত্বপূর্ণ আবিষ্কারগুলির সাথে থেমে থাকেনি, তবে অনেক উন্নতি এবং বিকল্পের রিপোর্ট করা হয়েছে। উদাহরণস্বরূপ, নির্দিষ্ট ব্যাটারি অ্যাপ্লিকেশনে ব্যবহারের জন্য নতুন ক্যাথোড উপাদানগুলি ক্রমাগত চিহ্নিত করা হয়েছে, এবং এই জাতীয় দুটি উপাদান গুডনেফের গ্রুপ থেকে উদ্ভূত হয়েছে: স্পিনেল উপাদান Li1-xMn2O4 এবং অলিভিন উপাদান LixFePO4 (LFP)।
[পাধি, একে; নাঞ্জুনদাস্বামী, কেএস; গুডনফ, রিচার্জেবল লিথিয়াম ব্যাটারির জন্য ইতিবাচক-ইলেকট্রোড উপাদান হিসাবে জেবি ফসফো-অলিভাইনস। জে ইলেক্ট্রোকেম। সমাজ 1997, 144, 1188-1194।
ঠাকরে, এমএম; ডেভিড, WIF; ব্রুস, পিজি; গুডনেফ, ম্যাঙ্গানিজ স্পিনেলগুলিতে জেবি লিথিয়াম সন্নিবেশ। মেটার Res. ষাঁড়. 1983, 18, 461-472]।
পরবর্তী উপাদানটি LixCoO2-এর তুলনায় Li+/Li-এর তুলনায় কিছুটা কম সম্ভাবনার দ্বারা সীমিত, তবে উচ্চ স্থিতিশীলতা রয়েছে এবং উচ্চ চার্জিং হারে ব্যবহার করা যেতে পারে। বেশ কিছু অন্যান্য ইলেক্ট্রোড উপকরণ এবং ইলেক্ট্রোলাইট সিস্টেমও আবিষ্কৃত হয়েছে, যা সমাজের সুবিধার জন্য সর্বদা উন্নত শক্তি সঞ্চয় উপকরণের দিকে পরিচালিত করে।
বৈদ্যুতিক গাড়িতে কোন ধরনের ব্যাটারি ব্যবহার করা হয়?
আজকাল, বেশিরভাগ ইভি লি-আয়ন ব্যাটারি ব্যবহার করে। এর আগে, Ni-MH এবং সীসা-অ্যাসিড ব্যাটারি ব্যবহার করা হয়েছিল, কিন্তু লি-আয়ন ব্যাটারির আবির্ভাবের কারণে তাদের ব্যবহার ধীরে ধীরে হ্রাস পেয়েছে, যা উচ্চ নির্দিষ্ট শক্তি এবং উচ্চ শক্তির ঘনত্বের মান ধারণ করে। লিড অ্যাসিড ব্যাটারির নির্দিষ্ট শক্তি প্রায় 40-50 Wh/kg হয় যেখানে Li-ion ব্যাটারিতে প্রায় 150 Wh/kg থাকে। সীসা-অ্যাসিড ব্যাটারির জন্য শক্তির ঘনত্বের মান হল 80-100 Wh/liter যেখানে Li-ion ব্যাটারির 250 Wh/litre বেশি।
নিকেল-কোবাল্ট-অ্যালুমিনিয়াম (NCA) ক্যাথোড এবং সিলিকন/গ্রাফাইট কম্পোজিট অ্যানোড সহ নলাকার কোষগুলি, যেমন সর্বশেষ টেসলা ব্যাটারি প্যাকগুলিতে (2019-2020) ব্যবহৃত হয়, প্রায় 270 Wh/kg এবং 650 Wh/লিটারে পৌঁছেছে। সাইন পাওয়ার দ্বারা লিসারিয়ন নামে একটি নতুন প্রযুক্তি 500 Wh/kg নির্দিষ্ট শক্তি এবং 1000 Wh/L শক্তির ঘনত্ব দাবি করে এবং> 0.4 Ah বিকাশ কোষে 450 চক্র।
ছোট ব্যাটারির জন্য, আমরা Wh এর পরিপ্রেক্ষিতে কথা বলি। উচ্চ ক্ষমতা সিস্টেমের জন্য, kWh ইউনিট ব্যবহার করা হয়। Wh মান 103 দিয়ে ভাগ করলে kWh দেবে।
এইভাবে 850 Wh = 850/1000 = 0.850 kWh.
আজকের EV ব্যাটারিতে ব্যবহৃত কোষগুলি 140 -170 Wh/kg নামমাত্র নির্দিষ্ট শক্তিতে পৌঁছাতে পারে। ফলস্বরূপ ব্যাটারি প্যাকের নির্দিষ্ট শক্তি সাধারণত 30 থেকে 40 শতাংশ কম, বা 80 -120 Wh/kg। হ্রাস অনেক সিরিজ এবং সমান্তরাল সংযোগকারী লিড, BMS এবং তাপ ব্যবস্থাপনা সিস্টেম (কুলিং বা গরম) এর কারণে। 2019 সালে, নন-সেল উপাদানগুলির প্যাক শতাংশ প্রায় 28% এ নেমে এসেছে।
এখন পর্যন্ত, কোষগুলি প্রথমে মডিউলগুলিতে স্থাপন করা হয়েছিল এবং তারপরে প্যাকগুলিতে রাখা হয়েছিল। উভয় সমসাময়িক Amperex প্রযুক্তি কো. লিমিটেড, চীন ( CATL) এবং টেসলা সিদ্ধান্ত নিয়েছে যে তারা মডিউলগুলি থেকে পরিত্রাণ পেতে এবং কোষগুলিকে সরাসরি প্যাকগুলিতে স্থাপন করতে চায়৷ CATL ইতিমধ্যেই তা করেছে এবং এটিকে সেল-টু-প্যাক প্রযুক্তি বলে। যদিও এই সম্পর্কে তথ্য খুব কম, কোম্পানি দাবি করে যে এটি নির্দিষ্ট শক্তিকে 10-15% বৃদ্ধি করতে পারে এবং ভলিউম ব্যবহার 15-20% দ্বারা উন্নত করতে পারে। মোট, এটি ব্যাটারি প্যাকের জন্য প্রয়োজনীয় অংশগুলিকে 40% কমাতে পারে বলে জানা গেছে। [https://cleantechnica.com/2020/02/18/how-catl-lithium-iron-phosphate-batteries-could-be-leading-to-100-kwh-tesla-model-3/]
লিথিয়াম ব্যাটারির উপাধি
ইন্টারন্যাশনাল ইলেক্ট্রোটেকনিক্যাল কমিশন (আইইসি) এবং ইন্ডিয়ান স্ট্যান্ডার্ড ইনস্টিটিউশন লিথিয়াম-আয়ন কোষের রসায়ন এবং আকার বর্ণনা করার জন্য একটি সাধারণ উপাধি প্রতিষ্ঠা করেছে।
পোর্টেবল অ্যাপ্লিকেশনের জন্য সেকেন্ডারি লিথিয়াম সেল এবং ব্যাটারি, আন্তর্জাতিক ইলেক্ট্রোটেকনিক্যাল কমিশন, IEC 61960-1 এবং IEC 61960-2 এবং IS 16047: 2012 ]।
অক্ষরগুলি রসায়ন এবং ফর্ম ফ্যাক্টরকে মনোনীত করে যখন সংখ্যাগুলি কোষের শারীরিক মাত্রা নির্দিষ্ট করে। প্রথম অক্ষরটি সাধারণ রসায়নকে বর্ণনা করে, দ্বিতীয় অক্ষরটি নির্দিষ্ট ক্যাথোড রসায়ন এবং তৃতীয় অক্ষরটি আকৃতি নির্দেশ করে।
প্রথম অক্ষর: আমি – লিথিয়াম-আয়ন রসায়ন
দ্বিতীয় অক্ষর: সি-কোবল্ট, এফ- আয়রন, এফপি- আয়রন ফসফেট, এন-নিকেল, এম-ম্যাঙ্গানিজ, এম-ম্যাঙ্গানিজ ফসফেট, টি-টাইটানিয়াম, ভি-ভানাডিয়াম এবং এক্স-অন্য।
তৃতীয় অক্ষর: আর- নলাকার, পি-প্রিজম্যাটিক
অনুসরণকারী প্রথম দুটি সংখ্যা mm-এ ব্যাস নির্ধারণ করে এবং শেষ তিনটি mm-এর দশমাংশে উচ্চতা নির্ধারণ করে। এইভাবে একটি কোষ মনোনীত ICR19/66 হল একটি কোবাল্ট ক্যাথোড সহ একটি লিথিয়াম আয়ন কোষ যার ব্যাস রয়েছে> 18 মিমি এবং ≤ 19 মিমি এবং সর্বোচ্চ সামগ্রিক উচ্চতা যা> 65 মিমি এবং ≤ 66 মিমি।
প্রিজম্যাটিক কোষগুলির জন্য প্রাথমিক অক্ষরগুলির একই অর্থ রয়েছে তবে প্রথম দুটি সংখ্যা mm-এ প্রস্থ নির্দেশ করে, পরের দুটি সংখ্যা mm উচ্চতা এবং শেষ দুটি সংখ্যা mm দৈর্ঘ্য। এইভাবে, একটি কোষ উপাধি IMP9/35/150 একটি ম্যাঙ্গানিজ ক্যাথোড কোষ সহ একটি প্রিজম্যাটিক লিথিয়াম আয়ন কোষকে বর্ণনা করে যার সর্বোচ্চ পুরুত্ব > 8 মিমি এবং ≤ 9 মিমি এবং সর্বাধিক প্রস্থ যা > 34 মিমি এবং ≤ 35 মিমি এবং সর্বোচ্চ সামগ্রিক উচ্চতা যা > 149 মিমি এবং ≤ 150 মিমি।
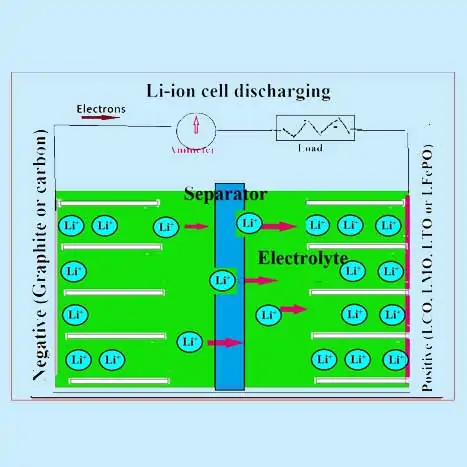
কিভাবে একটি লিথিয়াম-আয়ন ব্যাটারি কাজ করে?
কিভাবে লিথিয়াম আয়ন ব্যাটারি তৈরি করা হয়
পারমাণবিক সংখ্যা 3 সহ লিথিয়াম ধাতু, 0.534 g/cc ঘনত্ব, খুব কম আদর্শ হ্রাস সম্ভাবনা (Li + /Li দম্পতি -3.05 V বনাম SHE) এবং 3860 Ah/kg (2061 mAh/cc) এর তাত্ত্বিক নির্দিষ্ট ক্ষমতা সবচেয়ে হালকা ওজন, সর্বোচ্চ ভোল্টেজ, এবং সব ধাতুর সর্বশ্রেষ্ঠ শক্তি ঘনত্ব। (পরমাণু সংখ্যা 82 এর সীসার সাথে তুলনা করুন, ঘনত্ব 11.29 g/cc, 257.8 Ah/kg এর তাত্ত্বিক নির্দিষ্ট ক্ষমতা এবং -0.35V বনাম SHE এর মান হ্রাস সম্ভাবনা)।
লিথিয়াম আয়ন ব্যাটারি - সক্রিয় উপাদান
ধনাত্মক ইলেক্ট্রোডের সক্রিয় উপাদান হল LiCoO2 বা LiMnO2 বা LiFePO4-এর মতো মিশ্রিত অক্সাইডগুলির যেকোনো একটি। নেতিবাচক ইলেক্ট্রোড প্রধানত গ্রাফাইট এবং নিরাকার কার্বন যৌগ। একটি জৈব ইলেক্ট্রোলাইট (একটি বিচ্ছিন্ন লিথিয়াম পরিবাহী লবণ যেমন LIPF6) ব্যবহার করা হয়। একটি পলিপ্রোপিলিন (PP) বা পলিথিন (PE) বা মিশ্র বিভাজক ব্যবহার করা হয়। লিথিয়াম আয়নগুলি চার্জিং এবং ডিসচার্জের সময় লিথিয়াম-আয়ন ব্যাটারির ইলেক্ট্রোডগুলির মধ্যে পিছনে এবং পিছনে স্থানান্তরিত হয় এবং নীচে বর্ণিত হিসাবে সক্রিয় পদার্থের মধ্যে আন্তঃসংযোগ করা হয়:

চিত্র 9। একটি লিথিয়াম আয়ন কোষের একটি বিস্ফোরিত দৃশ্য
ক্রেডিট: ঝাং জেড., রামাদাস পি. (2012) লিথিয়াম-আয়ন ব্যাটারি সিস্টেম এবং প্রযুক্তি। ইন: Meyers RA (eds) টেকসই বিজ্ঞান ও প্রযুক্তির এনসাইক্লোপিডিয়া। স্প্রিংগার, নিউ ইয়র্ক, এনওয়াই, পিপি 6124। http s://doi.org/10.1007/978-1-4419-0851-3_663
কিভাবে লিথিয়াম আয়ন ব্যাটারি চার্জ
একটি লিথিয়াম আয়ন কোষে (LIB) স্রাব প্রক্রিয়া চলাকালীন অ্যানোড থেকে লিথিয়াম আয়নগুলি ইলেক্ট্রোলাইটে ডি-ইন্টারক্যালেটেড (বা নিষ্কাশিত) হয় এবং ইলেক্ট্রোলাইট থেকে এই লিথিয়াম আয়নগুলি ক্যাথোড উপাদানের মধ্যে আন্তঃসংযোগ করা হয় । অ্যানোড থেকে ক্যাথোডে আয়নগুলির এই গতিবিধি বহিরাগত সার্কিটে প্রবাহিত ইলেকট্রনের মুক্তির সাথে থাকে। বিপরীত প্রক্রিয়াটি চার্জিং প্রক্রিয়ার সময় ঘটে যেখানে লিথিয়াম আয়ন ক্যাথোড থেকে সরে যায় এবং ইলেক্ট্রোলাইটের মাধ্যমে অ্যানোডে ইন্টারক্যালেট করে । বাণিজ্যিক LIB সাধারণত ক্যাথোড উপাদান হিসাবে LiCoO 2 , LiMn 2 O 4 , এবং LiFePO 4 -এর মতো ট্রানজিশন মেটাল অক্সাইড ব্যবহার করে, যা একটি অ্যালুমিনিয়াম বর্তমান সংগ্রাহকের উপর আবৃত থাকে।
ইলেকট্রনিক পরিবাহিতা বাড়াতে এবং ইলেক্ট্রোড উপাদানের আরও ভাল আনুগত্য অর্জনের জন্য যথাক্রমে দশ থেকে বিশ শতাংশ পরিবাহী কার্বন এবং পলিভিনিলাইডিন %–10% (PVDF) এবং পলিটেট্রাফ্লুরোইথিলিন (PTFE) এর মতো পলিমেরিক বাইন্ডারের 5-10 শতাংশও সক্রিয় উপাদানের সাথে যোগ করা হয়। অ্যানোড উপাদান একটি তামার বর্তমান সংগ্রাহকের উপর আবরণ করা হয় যদি প্রয়োজনে কার্বন এবং PVDF পরিচালনা করে।
দুটি ইলেক্ট্রোড একটি ছিদ্র বিভাজক (10-20 μm পুরুত্বের পলিথিলিন বা পলিপ্রোপিলিন ফিল্ম) একটি ইলেক্ট্রোলাইট দ্রবণে ভিজিয়ে (একটি জৈব দ্রাবক LiPF6) দ্বারা পৃথক করা হয়। বিভাজক এবং ইলেক্ট্রোলাইট দ্রবণ উভয়েরই ভাল আয়নিক পরিবাহিতা থাকা উচিত। সেলটি সাধারণত জেলিরোল ফ্যাশনে একটি ধাতব আবরণে তৈরি করা হয় যার মধ্যে দুটি ইলেক্ট্রোডের মধ্যে একটি ইলেক্ট্রোলাইট-ডুবানো বিভাজক থাকে। একটি LIB এর একটি পরিকল্পিত পরিসংখ্যানে দেখানো হয়েছে, যেখানে সাধারণ চার্জ এবং ডিসচার্জ প্রক্রিয়াগুলি দেখানো হয়েছে।
লিথিয়াম-আয়ন (লি-আয়ন) রিচার্জেবল ব্যাটারিগুলি লিথিয়াম ইনসার্টেশন যৌগ নামক হোস্ট ম্যাট্রিক্স (ধনাত্মক এবং নেতিবাচক ইলেক্ট্রোড সক্রিয় পদার্থ) থেকে লিথিয়াম আয়ন (লি + ) (অতিথি প্রজাতি) এর একটি বিপরীত সন্নিবেশ/নিষ্কাশন নিযুক্ত করে যখন স্রাব এবং চার্জ হয়। প্রক্রিয়া ঘটে। লিথিয়াম আয়ন ব্যাটারিগুলিকে রকিং চেয়ার ব্যাটারি হিসাবে উল্লেখ করা হয়েছে কারণ লিথিয়াম আয়নগুলি ধনাত্মক এবং নেতিবাচক ইলেক্ট্রোডগুলির মধ্যে “রক” হিসাবে সেল চার্জ এবং ডিসচার্জ হয়।
ইতিবাচক সক্রিয় উপাদানটি সাধারণত একটি স্তরযুক্ত কাঠামো সহ একটি ধাতব অক্সাইড, যেমন লিথিয়াম কোবাল্ট অক্সাইড (LiCoO 2 ), বা একটি টানেল কাঠামোযুক্ত একটি উপাদান, যেমন লিথিয়াম ম্যাঙ্গানিজ অক্সাইড (LiMn 2 O 4 ) , বেশিরভাগই একটি অ্যালুমিনিয়াম বর্তমান সংগ্রাহকের উপর। . নেতিবাচক সক্রিয় উপাদানটি সাধারণত একটি গ্রাফিটিক কার্বন , এছাড়াও একটি স্তরযুক্ত উপাদান, বেশিরভাগই তামার বর্তমান সংগ্রাহকের উপর থাকে। চার্জ-ডিসচার্জ প্রক্রিয়ায়, লিথিয়াম আয়নগুলি সক্রিয় পদার্থের পারমাণবিক স্তরগুলির মধ্যে অন্তর্বর্তী স্থান থেকে ঢোকানো বা নিষ্কাশন করা হয়।
অ-জলীয় ইলেক্ট্রোলাইট বা জৈব ইলেক্ট্রোলাইট লিথিয়াম কোষে ব্যবহৃত হয়।
লিথিয়াম-আয়ন ব্যাটারির জন্য বিভাজক হল পলিওলিফিন মাইক্রোপোরাস ফিল্ম পলিথিন (PE) এবং পলিপ্রোপিলিন (PP)।

লিথিয়াম আয়ন ব্যাটারিতে ইলেক্ট্রোকেমিক্যাল সেল বিক্রিয়া
একটি সাধারণ লিথিয়াম আয়ন কোষে, নিম্নলিখিত জেনেরিক প্রতিক্রিয়া ঘটে।
ইতিবাচক ইলেক্ট্রোড প্রতিক্রিয়া:
LiMO 2 ⇔ Li 1-x MO 2 + x Li + + xe –
নেতিবাচক ইলেক্ট্রোড প্রতিক্রিয়া:
C + y Li + + ye – ⇔ Li y C
মোট কোষ বিক্রিয়া:
LiMO 2 + x/y C ⇔ x/y Li y C + Li 1-x MO 2
M = Co, Mn, Ni, Ti ইত্যাদি ধাতু।
সাধারণত x প্রায় 0.5 এবং y প্রায় 0.16, তাই x/y প্রায় 3. [জেফ ড্যান এবং গ্রান্ট এম. এহরলিচ। “লিথিয়াম আয়ন ব্যাটারি”, লিন্ডেনস হ্যান্ডবুক অফ ব্যাটারী, 4 তম সংস্করণ, থমাস বি রেড্ডি (সম্পাদনা), ম্যাকগ্রা
ইলেক্ট্রোলাইট এবং সলিড-ইলেক্ট্রোলাইট ইন্টারফেস (SEI)
আগেই বলা হয়েছে, লিথিয়াম কোষে অ-জলীয় ইলেক্ট্রোলাইট বা জৈব ইলেক্ট্রোলাইট ব্যবহার করা হয়। লি-কোষগুলি তুলনামূলকভাবে উচ্চ ভোল্টেজে কাজ করে, প্রতি কক্ষে 4.2 V পর্যন্ত। যদিও ভারী লিথিয়াম লবণ যেমন লিথিয়াম হেক্সাফ্লুরোফসফেট (LiPF6), লিথিয়াম হেক্সাফ্লুরো আর্সেনেট (LiAsF6), লিথিয়াম টেট্রাফ্লুরোবোরেট (LiBF4), লিথিয়াম পারক্লোরেট (LiClO4), লিথিয়াম ট্রাইফ্লুরোমেথানেসালফোনেট (LiPF6) লিথিয়াম ট্রাইফ্লুরোমেথানেসালফোনেট (LiPF6) ইত্যাদি। , প্রকৃত ইলেক্ট্রোলাইট (ইলেক্ট্রোলাইট সল্ট টেকসই) হয়, তাদের জন্য উপযুক্ত দ্রাবক প্রয়োজন যেমন উচ্চ ভোল্টেজে স্থিতিশীল। এই ধরনের বেশিরভাগ দ্রাবকের উচ্চ অস্তরক ধ্রুবক থাকে, যা সহজ আয়নিক বিচ্ছিন্নকরণ এবং অত্যন্ত ঘনীভূত লি-আয়নের অস্তিত্বকে সহজ করে। এই ধরনের দ্রাবক লি আয়নগুলির স্থিতিশীল অস্তিত্বের জন্য সলভেশন শিথ হিসাবেও কাজ করে, এইভাবে কাউন্টার অ্যানয়নগুলির প্রভাব হ্রাস করে।
উচ্চ অস্তরক ধ্রুবক থাকার অসুবিধা হল যে তাদের উচ্চ সান্দ্রতা মান রয়েছে যার ফলে আয়নগুলির গতিশীলতা হ্রাস পায় । নিম্ন আয়নিক পরিবাহিতা কাটিয়ে উঠতে, কম-সান্দ্র দ্রাবকগুলি সাধারণত উচ্চ সান্দ্র দ্রাবকের সাথে মিশ্রিত হয়। কিন্তু, যেহেতু কম-সান্দ্র দ্রাবকগুলির আয়নিক বিচ্ছিন্নতা কম থাকে তাই একটি সর্বোত্তম মিশ্রণ অনুপাতকে আঘাত করা অপরিহার্য হয়ে ওঠে যাতে মিশ্রণটির ভাল আয়নিক পরিবাহিতা এবং ভাল গতিশীলতা উভয়ই থাকে। অ-জলীয় দ্রাবক হিসেবে, কম সান্দ্র রৈখিক অ্যালকাইল কার্বনেটের সাথে ইথিলিন কার্বনেট (EC) এর মিশ্রণ যেমন ডাইমিথাইল কার্বোনেট (DMC), ডায়েথাইল কার্বোনেট (DEC), এবং ইথাইল মিথাইল কার্বোনেট (EMC) বাণিজ্যিকভাবে উপলব্ধ LIB-তে ব্যবহৃত হয়।
এপ্রোটিক দ্রাবকগুলি হল ইথার, এস্টার এবং অ্যালকাইল কার্বনেট: এগুলি হ’ল ডাইথাইল ইথার (ডিইই), টেট্রাহাইড্রোফুরান (টিএইচএফ), ডাইঅক্সোলেন, ইথিলিন কার্বনেট (ইসি), প্রোপিলিন কার্বনেট (পিসি), ডাইমিথাইল কার্বোনেট (ডিএমসি), ডাইথাইল কার্বনেট (ডিইসি), ইথাইল মিথাইল কার্বনেট (ইএমসি), মিথাইল ফরমেট, γ-বুটিরোল্যাকটোন (বিএল), মিথাইল অ্যাসিটেট, অ্যাসিটোনিট্রিল (এএন), ডাইমিথাইল সালফোক্সাইড (ডিএমএসও), ডাইমিথাইলফর্মাইড (ডিএমএফ), মিথাইল ক্লোরাইড, নাইট্রোমেথেন ইত্যাদি)
তরল ইলেক্ট্রোলাইট হল এক বা একাধিক জৈব দ্রাবক, সাধারণত কার্বনেটে লিথিয়াম লবণের দ্রবণ।
প্রোপিলিন কার্বনেট (পিসি) ইলেক্ট্রোলাইট হিসাবে ব্যবহার করা যাবে না যদি গ্রাফাইটকে অ্যানোড হিসাবে ব্যবহার করতে হয়, যেহেতু পূর্বের গ্রাফাইট পৃষ্ঠে পচে যায়; একা ব্যবহৃত PC, EC বা LiBOB এর ছোট সংযোজন ছাড়া) Li bisoxalato borate), গ্রাফাইট ইলেক্ট্রোডের অবনতি ঘটাতে পারে কারণ এটি লিথিয়ামের সাথে মিলিত হয়, ফলে এক্সফোলিয়েশন হয়।
ইলেক্ট্রোলাইট অপরিবর্তনীয় (চার্জের সময় ইলেক্ট্রোলাইট ছেড়ে যাওয়ার মতো একই সংখ্যক আয়ন প্রবেশ করে এবং
স্রাব)। ইলেক্ট্রোলাইট লবণ সাধারণত জৈব কার্বনেট দ্রাবকগুলিতে দ্রবীভূত হয়। প্রতিটি প্রস্তুতকারকের কাছে ইথিলিন কার্বনেট (EC) এর সাথে দ্রাবকগুলির একটি ভিন্ন সংমিশ্রণ রয়েছে যা বেশিরভাগের জন্য একটি সাধারণ হর
সলিড-ইলেক্ট্রোলাইট ইন্টারফেজ (SEI) স্তর গঠন ইলেক্ট্রোলাইট দ্বারা সঞ্চালিত আরেকটি গুরুত্বপূর্ণ ফাংশন। যখন একটি ক্ষার ধাতু একটি ব্যাটারি ইলেক্ট্রোলাইটে নিমজ্জিত হয়, বা যখন একটি নেতিবাচক সম্ভাবনা একটি কার্বন বা ইলেক্ট্রোলাইটে নিমজ্জিত একটি নিষ্ক্রিয় ইলেক্ট্রোডে প্রয়োগ করা হয়, তখন একটি SEI তৈরি হতে শুরু করে।
SEI স্তরটি দ্রবণের সাথে ধাতুর সংস্পর্শে তাত্ক্ষণিকভাবে গঠিত হয়, এতে ইলেক্ট্রোলাইট উপাদানগুলির অদ্রবণীয় এবং আংশিকভাবে দ্রবণীয় হ্রাস পণ্য থাকে। SEI হল মূল ফ্যাক্টর যা নিরাপত্তা, পাওয়ার ক্ষমতা, লিথিয়াম ডিপোজিটের রূপবিদ্যা, শেলফ লাইফ এবং ব্যাটারির সাইকেল লাইফ নির্ধারণ করে। অ্যানোডের ভাল আনুগত্যও গুরুত্বপূর্ণ।
উপরে যেমন জোর দেওয়া হয়েছে, ব্যবহারিক প্রাথমিক বা মাধ্যমিক ক্ষারীয় বা ক্ষার-আর্থ ব্যাটারিগুলি তখনই তৈরি করা যেতে পারে যদি অ্যানোডের দ্রবীভূত হওয়া বা ক্ষয় বন্ধ করা যায়। তাই, ইলেক্ট্রোলাইটকে এমনভাবে ডিজাইন করতে হবে যাতে অন্তত একটি SEI পূর্বসূর থাকে যা লিথিয়ামের সাথে (বা ক্ষার-ধাতুর অ্যানোডের সাথে) দ্রুত বিক্রিয়া করে একটি অদ্রবণীয় কঠিন-ইলেক্ট্রোলাইট ইন্টারফেস তৈরি করে। লবণের আয়ন হ্রাসের পণ্যগুলি সাধারণত অজৈব যৌগ যেমন LiF, LiCl এবং Li 2 O, যা ইলেক্ট্রোড পৃষ্ঠের উপর অবক্ষয় করে। Li 2 CO 3 এবং আংশিকভাবে দ্রবণীয় আধা কার্বনেট এবং পলিমারের মতো উভয় অদ্রবণীয় SEI উপাদানগুলির গঠন দ্বারা দ্রাবকের হ্রাস অনুসরণ করা হয়।
কার্বন ইলেক্ট্রোডের ক্ষেত্রে, যে ভোল্টেজটিতে SEI গঠিত হয় তা নির্ভর করে কার্বনের ধরন, এর পৃষ্ঠের অনুঘটক বৈশিষ্ট্য (ছাই সামগ্রী, ক্রিস্টালোগ্রাফিক সমতলের ধরন, বেসাল-টু-এজ সমতল অনুপাত), তাপমাত্রা, ঘনত্ব এবং দ্রাবকের প্রকার, লবণ এবং অমেধ্য এবং বর্তমান ঘনত্বের উপর। একটি লিথিয়াম-আয়ন ব্যাটারির প্রথম চার্জে, SEI গঠনের জন্য প্রধানত প্রয়োজন “অপরিবর্তনীয় ক্ষমতা ক্ষতি” (Q IR ) নামে একটি ক্ষমতার ক্ষতি হয়৷
SEI গঠন ছাড়াও, Q IR দ্রবণীয় হ্রাস পণ্য (Q SP ) গঠনের সাথে যুক্ত ক্ষমতা হ্রাসের কারণে হতে পারে।
ব্যাটারির দীর্ঘ চক্র জীবনের জন্য দূষণ-মুক্ত SEI অপরিহার্য। উচ্চ হারে এবং স্রাবের একটি বৃহত্তর গভীরতায় সাইকেল চালানোর সময় এটি আরও বেশি গুরুত্বপূর্ণ হয়ে ওঠে।
লিথিয়াম হেক্সাফ্লুরোফসফেট (LiPF6) এবং লিথিয়াম hexafluoroarsenate (LiAsF6) দ্রবণে SEI অন্যান্য লবণের দ্রবণের তুলনায় উচ্চ প্রতিরোধ ক্ষমতা রাখে। এটি প্রতিরোধ ক্ষমতা পরিবর্তনের কারণে যা প্রজাতি-নিয়ন্ত্রিত প্রতিরোধে অবদান রাখে যা LiPF6 এবং LiAsF6 ইলেক্ট্রোলাইটে লিথিয়াম অ্যানোডের উচ্চ ইন্টারফেসিয়াল প্রতিবন্ধকতার দিকে পরিচালিত করে। এছাড়াও, Li2CO3-কে লিথিয়াম-সাইক্লিং দক্ষতা বৃদ্ধির জন্য সর্বোত্তম প্যাসিভেটিং এজেন্টগুলির মধ্যে একটি হিসাবে বলা হয়েছে [J Electrochem Soc.,164 (7) A1703-A1719 (2017)]।
লিথিয়াম-আয়ন ব্যাটারির জন্য বিভাজক
লিথিয়াম-আয়ন ব্যাটারির জন্য বিভাজক হল পলিওলিফিন মাইক্রোপোরাস ফিল্ম এবং সাধারণত এককভাবে টানা পলিথিন (PE) এবং পলিপ্রোপিলিন (PP), বাইএক্সালি টানা PE বা মাল্টিএক্সালি টানা PP/PE/PP।
লিথিয়াম আয়ন ব্যাটারিতে সক্রিয় উপকরণের জন্য কাঁচামাল
লিথিয়াম আয়ন ব্যাটারি বিভিন্ন ক্যাথোড উপকরণ ব্যবহার করে। টাইটানিয়াম-নিওবিয়াম অক্সাইড অ্যানোড, লি-সি অ্যালয় ইত্যাদির মতো কয়েকটি ছাড়া অ্যানোডটি সর্বদাই কার্বন-ভিত্তিক। নিম্নলিখিত সারণী এবং চিত্রটি এই ব্যাটারিতে নিযুক্ত বিভিন্ন রসায়ন সম্পর্কে কিছু ধারণা দেয়।

চিত্র 12। লিথিয়াম আয়ন ব্যাটারির জন্য কিছু বর্তমান এবং ভবিষ্যতের ইলেক্ট্রোড রসায়ন বিকল্পের সারসংক্ষেপ। Li(Si) এর প্রস্তাবিত ক্ষমতা উপাদানটির তাত্ত্বিক ক্ষমতার 50%, যা কিছু পজিটিভ ইলেক্ট্রোড উপাদানের ক্ষেত্রে পাওয়া যায়।
[ক্রেডিট: Yu Miao, Patrick Hynan, Annette von Jouanne, and Alexandre Yokochi, Energies 2019, 12, 1074; doi:10.3390/en12061074]
1 নং টেবিল.
বিভিন্ন ক্যাথোড উপকরণ সহ লিথিয়াম আয়ন কোষের বৈশিষ্ট্য
| ক্যাথোড উপাদান | লি-নি-কো-আল (NCA) | Li-Ni-Mn-Co (NMC) | Li-MnO2 (LMO) | লি-আয়রন ফসফেট (LFP) | লি টাইটানেট (LTO) | লি কোবাল্ট অক্সাইড (LCO) |
|---|---|---|---|---|---|---|
| একটি ঘরের নামমাত্র ভোল্টেজ (V) | 3.6 | 3.65 (2.7-4.2) | 3.8 | 3.25 (2-3.6) | 3.2 | 3.6 |
| তাত্ত্বিক নির্দিষ্ট শক্তি (Wh/kg) | 279 | 256 | 148 | 128 (373) | 293 (175) | 274 (370) (x=0.5) |
| ক্যাথোডের জন্য নির্দিষ্ট ক্ষমতা (Ah/Kg) সম্ভাব্য বনাম Li/Li+ (V) | 180-200 (3.8) | 200 | 148 (4.1) | 150-170 (3.45) | 175 | 274 (3.9) (x=0.5) |
| ক্যাথোডের জন্য নির্দিষ্ট শক্তি (Wh/Kg) | 680-760 | 610-680 | 410-492 548 | 518-587 544 | -- | 546 |
| নিরাপত্তা | নিরাপদ | পরিমিত | নিরাপদ | উচ্চ | খুব ভালো | পরিমিত |
লিথিয়াম আয়ন ব্যাটারিতে ক্যাথোড উপকরণ
ক্যাথোড উপাদানগুলিকে অবশ্যই বেশ কয়েকটি প্রয়োজনীয়তা পূরণ করতে হবে যার উপর ইতিবাচক ইলেক্ট্রোড উপাদান নির্বাচন নির্ভর করে।
- উচ্চ ক্ষমতা প্রদানের জন্য, এই উপকরণগুলিকে তৈরি করা হিসাবে প্রচুর পরিমাণে লিথিয়াম অন্তর্ভুক্ত করতে হবে।
- আরও, দীর্ঘ চক্র জীবন, উচ্চ অ্যাম্পিয়ার আওয়ার দক্ষতা, এবং উচ্চ শক্তি দক্ষতার অনুমতি দেওয়ার জন্য উপাদানগুলিকে অবশ্যই সামান্য কাঠামোগত পরিবর্তনের সাথে বিপরীতভাবে আন্তঃসংযোগ করতে হবে।
- উচ্চ সেল ভোল্টেজ এবং উচ্চ শক্তির ঘনত্ব অর্জনের জন্য, লিথিয়াম বিনিময় প্রতিক্রিয়া অবশ্যই লিথিয়ামের তুলনায় উচ্চ সম্ভাবনায় ঘটতে হবে।
- উচ্চ হারের চার্জ এবং স্রাব প্রক্রিয়া সহজতর করার জন্য, উপাদানের বৈদ্যুতিন পরিবাহিতা এবং লিথিয়াম আয়ন গতিশীলতা অবশ্যই উচ্চ হতে হবে।
- ইতিবাচক ইলেক্ট্রোড উপাদান অবশ্যই ইলেক্ট্রোলাইটে দ্রবীভূত হবে না এবং অবশ্যই সাশ্রয়ী মূল্যে উপলব্ধ হতে হবে। খরচ কমাতে, কম খরচের প্রক্রিয়ায় সস্তা উপকরণ থেকে প্রস্তুতি পছন্দ করা হয়
LiFePO 4 এই নিয়মের ব্যতিক্রম। LiFePO 4 এ, ন্যানোমিটার কণার আকার বিশিষ্ট ইলেক্ট্রোড কণা ব্যবহার করে পর্যাপ্ত লিথিয়াম আয়ন পরিবহন করা হয়। [জেফ ড্যান এবং গ্রান্ট এম. এহরলিচ। “লিথিয়াম আয়ন ব্যাটারি”, লিন্ডেনস হ্যান্ডবুক অফ ব্যাটারী, 4 তম সংস্করণ, থমাস বি. রেড্ডি (সম্পাদনা), ম্যাকগ্রা হিল, পৃষ্ঠা 26.6, 2011]
লিথিয়াম আয়ন কোষে ইতিবাচক সক্রিয় পদার্থ (PAM) প্রস্তুতকারকের উপর নির্ভর করে পরিবর্তিত হয়। ক্যাথোড সামগ্রীকে তিনটি বিস্তৃত শ্রেণীতে শ্রেণীবদ্ধ করা যেতে পারে [ Arumugam Manthiram, Nature Communications (2020) 11:1550]। তারা হল:
স্তরযুক্ত অক্সাইড - লিথিয়াম আয়ন ব্যাটারিতে ক্যাথোড উপাদান
সাধারণ ধরনের LiMO 2 (যেখানে M = ভ্যানডিয়াম, ক্রোমিয়াম, কোবাল্ট এবং নিকেল) এর বেশ কয়েকটি অক্সাইড একটি স্তরযুক্ত কাঠামোতে স্ফটিক করে যেখানে Li + এবং M 3+ আয়ন একটি স্তরের ক্রম দেওয়ার জন্য বিকল্প [পাথর লবণ কাঠামোর লেনগুলি দখল করে। O-Li-OMO এর।
স্তরযুক্ত অক্সাইড ক্যাথোড LiCoO 2 -এ, Li + এবং trivalent Co 3+ আয়নগুলির মধ্যে বড় চার্জ এবং আকারের পার্থক্য ভাল ক্যাটেশন অর্ডারের দিকে পরিচালিত করে, যা লিথিয়াম সমতলে দ্রুত দ্বি-মাত্রিক লিথিয়াম-আয়ন বিস্তার এবং পরিবাহিতাকে সমর্থন করার জন্য গুরুত্বপূর্ণ।
ক্যাথোড উপাদানগুলির অত্যন্ত উচ্চ বিশুদ্ধতার মাত্রা প্রয়োজন এবং প্রায় সম্পূর্ণরূপে অবাঞ্ছিত ধাতব অমেধ্য থেকে মুক্ত হতে হবে – বিশেষত লোহা, ভ্যানডিয়াম এবং সালফার।

চিত্র 13। একটি স্তরযুক্ত কাঠামোর সরলীকৃত পরিকল্পিত যেখানে বিকল্প দখল রয়েছে
ক্লোজ-প্যাকড অক্সাইড আয়ন স্তরগুলির মধ্যে ক্যাটেশন স্তর।
[ক্রেডিট: Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.168]
উচ্চ বৈদ্যুতিক এবং লিথিয়াম-আয়ন পরিবাহিতা সহ ভাল কাঠামোগত স্থিতিশীলতা ভাল বিপরীতযোগ্যতার সাথে দ্রুত চার্জ-ডিসচার্জ বৈশিষ্ট্য সরবরাহ করে। এই বৈশিষ্ট্যগুলির সাথে, LiCoO2 ~4 V-এর উচ্চ অপারেটিং ভোল্টেজ সহ এখন পর্যন্ত সেরা ক্যাথোডগুলির মধ্যে একটি হিসাবে রয়ে গেছে। LiCoO2 ক্যাথোড সমাধান করা হয়েছে
1970 এর দশকে সালফাইড ক্যাথোডের সাথে যুক্ত দুটি প্রধান চ্যালেঞ্জ। এটা থেকে অপারেটিং ভোল্টেজ একটি যথেষ্ট বৃদ্ধি সক্রিয় না শুধুমাত্র< 2.5 V থেকে ~4 V কিন্তু একটি ধাতব লিথিয়াম অ্যানোড নিয়োগের প্রয়োজন ছাড়াই একটি কোষের সমাবেশ।
স্পিনেল অক্সাইড - লিথিয়াম আয়ন ব্যাটারিতে ক্যাথোড উপাদান
ক্যাথোডের দ্বিতীয় শ্রেণীর স্পিনেল LiMn 2 O 4 । (সাধারণ সূত্র হল AB 2 O 4 )। যদিও এই কাঠামোটি সাধারণত কিউবিক স্থানাঙ্কে চিত্রিত হয়, তবে এটিতে (111) সমতলগুলিতে অক্সাইড আয়নের সমান্তরাল স্তর রয়েছে এবং অক্সাইড আয়ন সমতলগুলির মধ্যে অষ্টহেড্রালি সমন্বিত সাইট এবং টেট্রাহেড্রালি সমন্বিত সাইট উভয়ই রয়েছে। অক্টাহেড্রাল সাইটের সংখ্যা অক্সাইড আয়নের সংখ্যার সমান, কিন্তু দ্বিগুণ টেট্রাহেড্রাল সাইট রয়েছে। ত্রিমাত্রিক কাঠামোগত স্থিতিশীলতা এবং উচ্চ বৈদ্যুতিক এবং লিথিয়াম-আয়ন পরিবাহিতা LiCoO 2 -এর তুলনায় ভাল বিপরীতমুখীতা সহ Li 1 – x Mn 2 O 4 এর জন্য আরও দ্রুত চার্জ-ডিসচার্জ বৈশিষ্ট্য সরবরাহ করে।
LiCoO 2 থেকে LiMn 2 O 4 তে যাওয়ার একটি গুরুত্বপূর্ণ সুবিধা হল খরচে উল্লেখযোগ্য হ্রাস কারণ ম্যাঙ্গানিজ কোম্পানির তুলনায় খরচে দুই অর্ডার কম। তবে, LiMn 2 O 4 -এর একটি জটিল সমস্যা হল Mn 3 -এর সুপরিচিত বৈষম্যের কারণে ইলেক্ট্রোলাইটে এইচ + আয়ন (অম্লতা) এর ট্রেস পরিমাণ (পিপিএম স্তর) উপস্থিতিতে জালি থেকে ইলেক্ট্রোলাইটে ম্যাঙ্গানিজ দ্রবীভূত করা। + থেকে Mn 4+ এবং Mn 2+ অ্যাসিডে।

চিত্র 14। স্পিনেল কাঠামোর পরিকল্পিত যেখানে ক্যাটেশনগুলি টেট্রাহেড্রাল এবং অষ্টহেড্রাল সাইটগুলির মধ্যে অক্সাইড আয়নের ক্লোজ-প্যাকড (111) সমতলগুলির মধ্যে বিতরণ করা হয় [ ক্রেডিট: Robert A. Huggins, Advanced Batteries, Material Science Aspects, Springer, New York, 2009, p.17]।
উচ্চ ভোল্টেজ লিথিয়াম-নিকেল-ম্যাঙ্গানিজ অক্সাইড (LNMO) ক্যাথোড উপাদান পরবর্তী প্রজন্মের ব্যাটারিতে প্রতিশ্রুতিবদ্ধ বলে মনে হচ্ছে। কিন্তু হোঁচট খায় এমন একটি ইলেক্ট্রোলাইটের অভাব যা একটি LNMO-ভিত্তিক ব্যাটারির চাপ সামলাতে পারে। LNMO ক্যাথোড ভিত্তিক ব্যাটারি কোষগুলি অন্যান্য উচ্চ-কার্যক্ষমতা সম্পন্ন লিথিয়াম ভিত্তিক ব্যাটারির সমান ফলাফল প্রদান করে, তবে যথেষ্ট কম খরচে।
যাইহোক, ইলেক্ট্রোলাইট নির্মাতারা চলমান গবেষণা এবং উন্নয়ন থেকে খুব আশাব্যঞ্জক ফলাফল পাচ্ছেন যা কিছু সময়ে ইলেক্ট্রোলাইট তৈরি করবে যা একটি LNMO ব্যাটারি কোষে ভালভাবে কাজ করবে। https://blog.topsoe.com/the-cathode-material-for-next-generation-lithium-ion-batteries-is-ready
অতি সম্প্রতি, এনএমসি ক্যাথোডগুলিতে নি কন্টেন্ট বাড়ানো এবং কোবাল্টের উপাদান কমানো বা নির্মূল করা অনেক বেশি বিশিষ্ট হয়ে উঠছে [ লি, ডব্লিউ., এরিকসন., ই. এবং মন্থিরাম, এ. লিথিয়াম-ভিত্তিক স্বয়ংচালিত ব্যাটারির জন্য উচ্চ-নিকেল স্তরযুক্ত অক্সাইড ক্যাথোড , ন্যাট। শক্তি 5, 26 – 24 (2020)]।
পলি-অ্যানিয়ন অক্সাইড - লিথিয়াম আয়ন ব্যাটারিতে ক্যাথোড উপাদান
তৃতীয় শ্রেণীর অক্সাইড হল পলিয়ানিয়ান অক্সাইড। Fe 2 (MoO 4 ) 3 এবং Fe 2 (WO 4 ) 3 এর মত পলিয়ান অক্সাইডগুলি Li 2 Fe 2 (MoO 4 ) 3 বা Li 2 Fe 2 ( Li 2 Fe 2 (MoO 4 ) 3 বা Li 2 Fe 2 ( দিতে ফর্মুলা ইউনিটে দুটি লিথিয়াম আয়নগুলির বিপরীতমুখী সন্নিবেশ/ নিষ্কাশনের মধ্য দিয়ে) পাওয়া গেছে WO 4 ) 3 উভয় রাসায়নিক এবং ইলেক্ট্রোকেমিক্যাল পদ্ধতি দ্বারা
[Manthiram, A., Goodenough, JB লিথিয়াম Fe 2 (MO 4 ) 3 কাঠামোতে সন্নিবেশ করান: M = W-এর সাথে M = Mo এর তুলনা। জে. সলিড স্টেট কেম। 71, 349– 360 (1987)]।
মন্থিরাম এবং গুডনেফের কাজের উপর ভিত্তি করে,
[মন্থিরাম, এ. এবং গুডনেফ, জেবি লিথিয়াম ফে 2 (এমও 4 ) 3 ফ্রেমওয়ার্কে সন্নিবেশ করান: M = W-এর সঙ্গে M = Mo-এর তুলনা। জে. সলিড স্টেট কেম। 71, 349-360 (1987)। Manthiram, A. & Goodenough, JB লিথিয়াম Fe 2 (SO 4 ) 3 কাঠামোতে সন্নিবেশ করান। জে. পাওয়ার সোর্স 26, 403-406 (1989)।]
ক্যাথোড হিসাবে লিথিয়াম-ধারণকারী ফসফেটগুলির অন্বেষণের ফলে অলিভাইন LiFePO 4 কে ক্যাথোড হিসাবে সনাক্ত করা হয়েছে [পাধি, AK, নানজুন্ডস্বামী, কেএস এবং গুডেনফ, জেবি ফসফো-অলিভাইনস রিচার্জেবল লিথিয়াম ব্যাটারির জন্য ইতিবাচক ইলেক্ট্রোড উপাদান হিসাবে। জে ইলেক্ট্রোকেম। সমাজ 144, 1188-1194 (1997] 1997 সালে।
কিন্তু, পলিয়ানিয়ান অক্সাইড শ্রেণী দুর্বল ইলেকট্রনিক পরিবাহিতা থেকে ভুগছে। [ অরুমুগাম মন্থিরাম, নেচার কমিউনিকেশনস (2020) 11:1550]।
ক্যাথোড হিসাবে লিথিয়াম-ধারণকারী ফসফেটগুলির অন্বেষণের ফলে অলিভাইন LiFePO 4 কে ক্যাথোড হিসাবে সনাক্ত করা হয়েছে [পাধি, AK, নানজুন্ডস্বামী, কেএস এবং গুডেনফ, জেবি ফসফো-অলিভাইনস রিচার্জেবল লিথিয়াম ব্যাটারির জন্য ইতিবাচক ইলেক্ট্রোড উপাদান হিসাবে। জে ইলেক্ট্রোকেম। সমাজ 144, 1188-1194 (1997] 1997 সালে।
কিন্তু, পলিয়ানিয়ান অক্সাইড শ্রেণী দুর্বল ইলেকট্রনিক পরিবাহিতা থেকে ভুগছে। [ অরুমুগাম মন্থিরাম, নেচার কমিউনিকেশনস (2020) 11:1550]।
ক্যাথোড সামগ্রী তৈরি - লিথিয়াম আয়ন ব্যাটারি
এর আগে, লিথিয়াম ধাতু অক্সাইড ক্যাথোড যৌগগুলি দ্রবণে সঞ্চালিত রাসায়নিক প্রতিস্থাপন প্রতিক্রিয়াগুলির একটি সিরিজের মাধ্যমে লিথিয়াম কার্বনেট এবং নির্বাচিত ধাতুর লবণ থেকে তৈরি করা হয়েছিল। পছন্দসই পণ্যটি অবক্ষয়িত এবং স্প্রে-শুকানো হয়।
LiCoO 2 প্রথম চিত্রে নির্দেশিত প্রচলিত সংশ্লেষণ পদ্ধতি দ্বারা প্রস্তুত করা হয়েছিল । ট্রাইকোবাল্ট টেট্রাঅক্সাইড (Co 3 0 4 ) এবং লিথিয়াম কার্বনেট (Li 2 CO 3 ) ভালভাবে মিশ্রিত হয়েছিল, তারপরে প্রায় 950ºC তাপমাত্রায় বায়ু প্রবাহে ক্যালসিনেশন করা হয়েছিল। এই পদ্ধতিতে, তবে, LiCoO 2 এর মোটা কণা প্রস্তুত করা খুব কঠিন ছিল এবং শুধুমাত্র 1-3 pm ব্যাসযুক্ত সূক্ষ্ম কণা পাওয়া যেত।
সূক্ষ্ম সক্রিয় ইলেক্ট্রোড উপকরণ নিরাপত্তা দৃষ্টিকোণ থেকে পছন্দসই নয়। বাহ্যিক শর্ট সার্কিট বা ক্রাশিংয়ের মতো অপব্যবহারের ক্ষেত্রে, বৃহৎ নির্দিষ্ট পৃষ্ঠের ক্ষেত্রফল সহ সূক্ষ্ম কণাগুলি সহজেই এক সময়ে প্রতিক্রিয়া দেখায় এবং তাপমাত্রা বৃদ্ধির সাথে সাথে খুব অল্প সময়ের মধ্যে সমস্ত কোষের শক্তি হঠাৎ করে নির্গত হয়। সবচেয়ে খারাপ ক্ষেত্রে, সেলটি আগুন ধরতে পারে [ইয়োশিও নিশি, লিথিয়াম আয়ন ব্যাটারিতে, এম. ওয়াকিহারা এবং 0. ইয়ামামোটো (এডস।)। পৃষ্ঠা 192-193]।
কিভাবে লিথিয়াম আয়ন ব্যাটারি তৈরি করা হয়? ফ্লোচার্ট
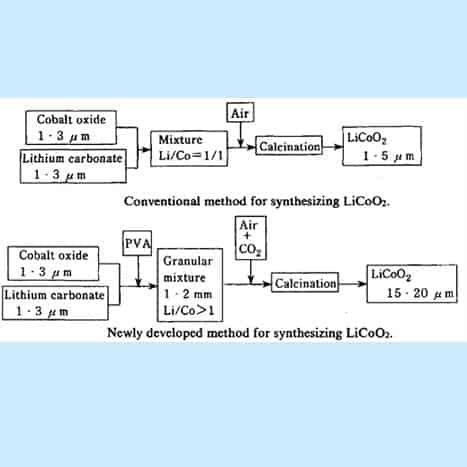
চিত্র 15। Li-CoO 2 তৈরির জন্য ফ্লোচার্ট
[ক্রেডিট: ইয়োশিও নিশি, লিথিয়াম আয়ন ব্যাটারিতে, এম. ওয়াকিহারা এবং 0. ইয়ামামোটো (এডস।)। পৃষ্ঠা 192-193]।
বৃহত্তর কণার আকারের লিথিয়াম কোবাল্টাইট সংশ্লেষণের জন্য একটি উন্নত প্রক্রিয়া: প্রথম পয়েন্টটি হল কাঁচামালের মিশ্রণে (Co 3 0 4 এবং Li 2 CO 3 )) অল্প পরিমাণে পিভিএ রজন যোগ করা হয় যাতে একটি গ্রানুলেটর দিয়ে দানাদার ছুরি তৈরি করা হয়। . উপযুক্ত পরিমাণ C0 2 গ্যাসযুক্ত বায়ুপ্রবাহে পেলেটগুলিকে সিন্টার করার মাধ্যমে, 20pm এর গড় ব্যাস সহ লিথিয়াম কোবাল্টাইট কণাগুলি সংশ্লেষিত হয়। দ্বিতীয় বিন্দু হল যে আমরা কাঁচামালে সামান্য অতিরিক্ত পরিমাণে লিথিয়াম কার্বনেট (Li 2 CO 3 ) ব্যবহার করি, তাই কাঁচামালে Li/Co পারমাণবিক অনুপাত একের বেশি। এই পদ্ধতিটি মোটা কণা প্রাপ্তির জন্যও অনুকূল, এবং উপরন্তু, ফলে LiCoO 2 -এ অল্প পরিমাণে অবশিষ্ট Li 2 CO 3 রয়েছে।
প্রথম বিন্দুটি হল যে কাঁচামালের মিশ্রণে (Co304 এবং Li 2 CO 3 ) অল্প পরিমাণে PVA রজন যোগ করা হয় যাতে একটি দানাদারের সাহায্যে দানাদার ছুরি তৈরি করা হয়। লিথিয়াম কোবাল্ট অক্সাইডকে সিন্টারিং করে লিথিয়াম কার্বনেট Li 2 CO 3 এবং কোবাল্ট অক্সাইড, Co 3 O 4 বা ধাতব কোবাল্টের 600-800 °C তাপমাত্রায় উচ্চ-তাপমাত্রার অগ্নিসংযোগের মাধ্যমে সহজেই প্রস্তুত করা যেতে পারে, তারপর পণ্যটিকে অ্যানিলিং করে অনেক ঘন্টা ধরে 900°C, সবই একটি অক্সিজেন বায়ুমণ্ডলের অধীনে।
এটি 750-900°C পর্যন্ত লিথিয়াম হাইড্রোক্সাইডের সাথে হাইড্রেটেড অক্সাইডের ক্যালসিনেশনের মাধ্যমেও পাওয়া যেতে পারে।
তৃতীয় পদ্ধতিতে পানির দ্রবণে লিথিয়াম অ্যাসিটেট, কোবাল্ট অ্যাসিটেট এবং সাইট্রিক অ্যাসিড সমান মোলার পরিমাণে ব্যবহার করা হয়। 80 ডিগ্রি সেলসিয়াসে গরম করা মিশ্রণটিকে একটি সান্দ্র স্বচ্ছ জেলে পরিণত করে। শুকনো জেলটি তারপর গ্রাউন্ড করা হয় এবং ধীরে ধীরে 550 ডিগ্রি সেলসিয়াসে গরম করা হয়। (https://en.wikipedia.org/wiki/Lithium_cobalt_oxide)।
কিছু সাধারণ উদাহরণ হল: সল-জেল পদ্ধতি
একটি সল-জেল প্রক্রিয়ায়, বিক্রিয়কগুলির জলীয় দ্রবণ এবং একটি চেলেটিং এজেন্ট দ্রবণ মিশ্রিত হয়। দ্রাবকের ধীরগতিতে বাষ্পীভবন একটি সল তৈরি করে এবং সলকে মাঝারি গরম করে তাই প্রাপ্ত একটি জেল তৈরি করে। পরেরটি পছন্দসই পণ্য পেতে উপযুক্ত তাপমাত্রায় ক্যালসাইন করা হয়।
উদাহরণ 1.
বিভিন্ন জটিল এজেন্ট থেকে LiCoO 2 এর সংশ্লেষণ: ব্যবহৃত লবণগুলি ছিল কোবাল্ট নাইট্রেট হেক্সা হাইড্রেট (Co(NO 3 ) 2 .6H 2 O, এবং লিথিয়াম নাইট্রেট, নির্জল LiNO 3 । জেলটি চারটি ভিন্ন কমপ্লেক্সিং এজেন্ট ব্যবহার করে তৈরি করা হয়েছিল: সাইট্রিক অ্যাসিড, অ্যানহাইড্রাস (C 3 H 4 OH(COOH) 3 , গ্লাইসিন, (H 2 NCH 2 COOH); স্টার্চ (বাণিজ্যিক কর্ন স্টার্চ এবং জেলটিন))।
Li:Co = 1.1:1 অনুপাত সহ 20 মিলি জলে LiNO 3 এবং Co(NO 3 ) 2 .6H 2 O সম্বলিত পাঁচটি সমাধান প্রস্তুত করা হয়েছে। প্রতিটি দ্রবণে একটি নির্দিষ্ট জটিল এজেন্ট যোগ করা হয়: ( i ) সাইট্রিক অ্যাসিড (4.611 গ্রাম) 5 মিলি জলে মিশ্রিত করা হয়; ( ii ) গ্লাইসিন (1.501 গ্রাম); ( iii ) স্টার্চ (1.250 গ্রাম); ( iv ) জেলটিন (3.500 গ্রাম) এবং ( v ) ফাঁকা পরীক্ষা।
প্রথম চারটি দ্রবণ 70 থেকে 80 ডিগ্রি সেলসিয়াস তাপমাত্রায় একটি গ্লিসারিন স্নানে জেল তৈরি না হওয়া পর্যন্ত গরম করা হয়। প্রতিটি জেলিং এজেন্টের জন্য এই প্রক্রিয়ার সময়ের পরিমাণ আলাদা: ( i ) সাইট্রিক অ্যাসিড (5 ঘন্টা), ( ii ) গ্লাইসিন (3 ঘন্টা), ( iii ) স্টার্চ (1 ঘন্টা), ( iv ) জেলটিন (3 ঘন্টা) . সমস্ত নমুনার জন্য ক্রিস্টালাইন পাউডারের উত্পাদন একটি মাফল ফার্নেসে দুটি পর্যায়ে সঞ্চালিত হয়েছিল: প্রথমে 20-30 মিনিটের জন্য 300 ডিগ্রি সেলসিয়াসে উপকরণগুলিকে ফায়ার করে এবং পরে 24 ঘন্টার জন্য 700 ডিগ্রি সেলসিয়াসে গরম করা হয়৷ [ব্রুনো জিএ ফ্রেইটাস এবং অন্যান্য, জে. ব্রাজ। কেম। সমাজ 28, 11, নভেম্বর 2017]।
উদাহরণ 2।
একটি Sol-জেল পদ্ধতি দ্বারা প্রস্তুত
LiNO3 প্রথমে সাইট্রিক অ্যাসিড দ্রবণে দ্রবীভূত হয়। LiNO3, Ni(NO3)2.6H2O Co(Ac)2.4H2O এবং Mg(NO3)2.6H2O LiNi 0.7 – 𝑥 M 𝑥 Co 0.3 O2 (0 ⥽⥽❑ ❑ তে লিথিয়াম, নিকেল, কোবাল্ট, এবং ম্যাগনেসিয়ামের প্রারম্ভিক উপকরণ হিসাবে ব্যবহৃত হয়েছিল) 0.1), যথাক্রমে। সাইট্রিক অ্যাসিডের পরিমাণ Co, Ni এবং Mg এর মোট মোলার পরিমাণের সমান। তারপরে, Co(Ac)2 4H2O, Ni(NO3)2 6H2O এবং Mg(NO3)2 6H2O মিশ্রণে যোগ করা হয়েছিল। পুরো মিশ্রণটি 80∘C তাপমাত্রায় জল স্নানের মাধ্যমে গরম করা হয়েছিল। গরম করার প্রক্রিয়া চলাকালীন, কোনও বৃষ্টিপাত ছাড়াই একটি পরিষ্কার, গোলাপী দ্রবণ তৈরি হয়। অবশেষে, পরিষ্কার দ্রবণটি ধীরে ধীরে শুকিয়ে জেলে পরিণত হয়েছিল। জেরোজেলটি শুকানো হয়, মাটি করা হয় এবং তারপর একটি চুলায় 120 ডিগ্রি সেলসিয়াসে 12 ঘন্টার জন্য তাপ-চিকিত্সা করা হয়।
জেলের পূর্বসূরীটি 500 ডিগ্রি সেলসিয়াস তাপমাত্রায় 6 ঘন্টার জন্য ক্যালসিন করা হয়েছিল এবং একটি টিউব-চুল্লিতে ঘরের তাপমাত্রায় ঠান্ডা করা হয়েছিল। তাপ-চিকিত্সা পণ্য গুঁড়ো প্রাপ্ত করার জন্য একটি এগেট মর্টার মধ্যে মাটি ছিল. এবং তারপর পাউডারটি 12 ঘন্টার জন্য 800 ডিগ্রি সেলসিয়াসে ক্যালসাইন করা হয়েছিল। ক্যাথোড তৈরির জন্য, প্রস্তুত পণ্যগুলিকে প্রথমে 𝑁-মিথাইল পাইরোলিডোন (NMP) এ অ্যাসিটিলিন কালো এবং পলিভিনাইলাইডিন ফ্লোরাইড (ওজনে 80:8:12) মিশ্রিত করা হয়েছিল। প্রাপ্ত স্লারিটি তারপর আল ফয়েলের উপর প্রলেপ দেওয়া হয় এবং আরও রোল চাপার জন্য 18 ঘন্টার জন্য 80 ডিগ্রি সেলসিয়াসে শুকানো হয়। . [ হেইলাং ঝাং, অ্যাডভান্সেস ইন ম্যাটেরিয়ালস সায়েন্স অ্যান্ড ইঞ্জিনিয়ারিং ভলিউম 2014, আর্টিকেল আইডি 746341, ]

চিত্র 16। লিথিয়াম ম্যাঙ্গানেট প্রস্তুত করতে সল-জেল প্রক্রিয়ার জন্য ফ্লো চার্ট
( ক্রেডিট: YS Lee, YK Sun and KS, Nahm, Solid State Ionics 109 (1998) 285 যেমন দেওয়া হয়েছে, M. Pasquali, S. Passerini এবং G Pistoia, লিথিয়াম ব্যাটারি, বিজ্ঞান ও প্রযুক্তিতে, ed. GA Nazri এবং G. Pistoia, Springer, New York, (2009), p. 318)
লিথিয়াম আয়ন ব্যাটারিতে অ্যানোড সামগ্রী তৈরি করা
উন্নত শক্তি এবং শক্তির ঘনত্ব সহ LIB-এর দিকে এগিয়ে যাওয়ার উত্সাহজনক পথ হল উপযুক্ত অ্যানোড সামগ্রীর নির্বাচন যা উচ্চ ক্ষমতা প্রদান করতে পারে এবং অ্যানোডে লি-আয়নগুলির বিচ্ছুরণ সহজতর করতে পারে, পাশাপাশি ভাল চক্র জীবন এবং নিরাপত্তা উদ্বেগ থেকে মুক্ত।
পূর্ববর্তী পদার্থের উপর ভিত্তি করে, কার্বন অ্যানোডগুলিকে নীচে দেওয়া হিসাবে বিভিন্ন প্রকারে শ্রেণীবদ্ধ করা যেতে পারে।
পূর্বসূরি উপাদান এবং প্রক্রিয়াকরণ পরামিতি উত্পাদিত কার্বন প্রকৃতি নির্ধারণ করে। উচ্চ তাপমাত্রায় (2000 থেকে 3000 ডিগ্রি সেলসিয়াস) চিকিত্সার মাধ্যমে গ্রাফিটাইজ করা যায় এমন পদার্থকে নরম কার্বন বলা হয়।
গ্রাফিটাইজেশনের পরে, ক্রমবর্ধমান তাপমাত্রার সাথে টার্বোস্ট্র্যাটিক ডিসঅর্ডারটি ধীরে ধীরে অপসারণ করা হয় এবং উপাদানের চাপ উপশম হয় [টি. ঝেং, জেএন রেইমারস এবং জেআর ড্যান, শারীরিক রেভ. বি 51 , 734 (1995)] হার্ড কার্বন , যেমন ফেনোলিক রজন থেকে প্রস্তুত, সহজেই গ্রাফিটাইজ করা যায় না, এমনকি যখন 3000 ডিগ্রি সেলসিয়াসে চিকিত্সা করা হয়। কোক-টাইপ উপকরণগুলি প্রায় 1000 ডিগ্রি সেলসিয়াসে প্রস্তুত করা হয়, সাধারণত একটি সুগন্ধযুক্ত পেট্রোলিয়াম পূর্বসূর থেকে [জেফ ড্যান এবং গ্রান্ট এম. এহরলিচ। “লিথিয়াম আয়ন ব্যাটারি”, লিন্ডেনস হ্যান্ডবুক অফ ব্যাটারী, 4 তম সংস্করণ, টমাস বি রেড্ডি (সম্পাদনা), ম্যাকগ্রা হিল, পিপি 26., 2011]

চিত্র 17। কার্বন অ্যানোড পদার্থের অগ্রদূত শ্রেণীবিভাগ
[ক্রেডিট: জেফ ড্যান এবং গ্রান্ট এম. এহরলিচ। “লিথিয়াম আয়ন ব্যাটারি”, লিন্ডেনস হ্যান্ডবুক অফ ব্যাটারী, 4 তম সংস্করণ, টমাস বি রেড্ডি (সম্পাদনা), ম্যাকগ্রা হিল, পিপি 26., 2011]
গোরিপার্টি LIB-এর অ্যানোড উপাদানগুলিকে লিথিয়ামের সাথে তাদের প্রতিক্রিয়া প্রক্রিয়ার উপর নির্ভর করে তিনটি বিভাগে বিভক্ত করে [ সুব্রহ্মণ্যম গোরিপার্টি, এরমানো মিয়েল, ফ্রান্সেসকো ডি অ্যাঞ্জেলিস, এনজো ডি ফ্যাব্রিজিও, রেমো প্রোয়েটি জাকারিয়া, ক্লাউডিও ক্যাপিগলিয়া, জে পাওয়ার সোর্স 257 (2014) 42]4
ইন্টারক্যালেশন/ডি-ইন্টারকেলেশন গ্রুপ
এই শ্রেণীর অ্যানোডের মধ্যে রয়েছে কার্বোনাসিয়াস এবং টাইটানিয়াম অক্সাইড উপাদান। স্টোরেজ ক্ষমতা যা একটি ইন্টারক্যালেশন পাথের মাধ্যমে ঘটে তা পৃষ্ঠের ক্ষেত্রফল, রূপবিদ্যা, স্ফটিকতা এবং এর অভিযোজনের সাথে ঘনিষ্ঠভাবে জড়িত। নরম কার্বনগুলি সাধারণত ভালভাবে গৃহীত হয় এবং ব্যাটারি শিল্পে ব্যবহৃত হয়। এটি দেখা গেছে যে নরম কার্বন বেশ পরিপক্ক প্রযুক্তি, যখন হার্ড কার্বন একটি আকর্ষণীয় বিকল্প সমাধান উপস্থাপন করতে পারে বিশেষত বৈদ্যুতিক যানবাহনের ক্ষেত্রে উচ্চ ক্ষমতার প্রয়োজন এমন অ্যাপ্লিকেশনগুলির জন্য। টাইটানিয়াম অক্সাইড অ্যানোডগুলি ইতিমধ্যে কিছু ব্যাটারি শিল্প দ্বারা ব্যবহৃত হয়।


গ্রাফিনও ব্যাপকভাবে পর্যালোচনা করা হয়েছিল। বিশেষ করে, এটি দেখা গেছে যে তাদের বৈদ্যুতিক বৈশিষ্ট্যগুলি এই উপাদানটিকে হাইব্রিড গ্রাফিন/ধাতু অ্যানোডের জন্য বিশেষভাবে উপযুক্ত করে তোলে (উদাহরণস্বরূপ SnO2 এবং Fe2O3 সহ গ্রাফিন)। কার্বন ন্যানো-টিউব (CNTs) তাদের খুব আকর্ষণীয় একাডেমিক ফলাফলের জন্য উল্লেখযোগ্য ছিল, যদিও উৎপাদন খরচ ভবিষ্যতে ব্যাটারি শিল্পে অ্যানোড সক্রিয় উপাদান হিসাবে তাদের প্রয়োগকে বাধা দিতে পারে।


যাইহোক, বড় ইভি ব্যাটারির জন্য, খরচ বিবেচনার কারণে কম দামের গ্রাফাইট সাধারণত পছন্দ করা হয়।
একটি দ্বিতীয় বিভাগে, Si, Ge, SiO, SnO2 এর মতো খাদযুক্ত উপকরণগুলি বর্ণনা করা হয়েছিল। এই উপকরণগুলি পূর্ববর্তী গোষ্ঠীর তুলনায় বৃহত্তর ক্ষমতা এবং উচ্চ শক্তির ঘনত্ব প্রদান করতে পারে, একটি খাদ/ডি-অ্যালয় ইলেক্ট্রোকেমিক্যাল প্রক্রিয়ায় লিথিয়ামের সাথে বিক্রিয়া করে। যাইহোক, এই প্রক্রিয়াটি বৃহৎ আয়তনের সম্প্রসারণকে বোঝায় যার ফলে সাইকেল চালানোর সময় যথেষ্ট ক্ষমতা হ্রাস পায়। বাল্ক মাত্রা থেকে ন্যানোস্কেলে হ্রাস, পরিবাহী ম্যাট্রিক্সের সাথে সংমিশ্রণ দ্বারা জটিল কাঠামোর উপলব্ধি সহ, উপরোক্ত-নির্দিষ্ট সমস্যাগুলি কাটিয়ে উঠতে এবং সামগ্রিক অ্যানোড কর্মক্ষমতা উন্নত করার জন্য প্রস্তাব করা হয়েছে।
সিলিকন এবং SnO2 এবং কার্বনের সাথে তাদের সংমিশ্রণ হল ভবিষ্যতের লিথিয়াম ব্যাটারির অ্যাপ্লিকেশনের জন্য সবচেয়ে প্রতিশ্রুতিশীল উপকরণ, তবে, অ্যানোড উপাদান হিসাবে তাদের ব্যাপক উত্পাদনের জন্য একটি সস্তা উপায় এখনও প্রয়োজনীয়। অন্যদিকে, Ge, যদিও তার বৈদ্যুতিক রাসায়নিক বৈশিষ্ট্য এবং চমৎকার পরীক্ষামূলক পরীক্ষাগারের ফলাফলের জন্য আকর্ষণীয়, পৃথিবীর ভূত্বকের প্রাচুর্যের দিক থেকে পঞ্চাশতম র্যাঙ্কের উপাদান হওয়ার কারণে ত্রুটির সম্মুখীন হয়। অতএব, লিথিয়াম ব্যাটারি প্রযুক্তি ভর প্রয়োগের জন্য এটি একটি ভাল বিকল্প হতে পারে না।
তৃতীয় গ্রুপে, রূপান্তর প্রতিক্রিয়া ফ্যাশনে লিথিয়ামের সাথে বিক্রিয়াকারী উপকরণগুলি বর্ণনা করা হয়েছিল। বিশেষ করে, ধাতব অক্সাইড/ফসফাইড/নাইট্রাইড/সালফাইড বিবেচনা করা হয়েছিল। যাইহোক, এই উপকরণগুলি এখনও বৃহৎ বাণিজ্যিক লিথিয়াম ব্যাটারি বাজার থেকে অনেক দূরে, দুর্বল ক্ষমতা ধারণ এবং বড় সম্ভাব্য হিস্টেরেসিস কারণে। অতএব, উপরের চিহ্নিত সমস্যাগুলি সমাধানের জন্য এই উপকরণগুলির বিভিন্ন ন্যানো-গঠিত ফর্মগুলিও তদন্ত করা হয়েছে।
একটি ন্যানোপ্রযুক্তি অবশ্যই লিথিয়াম ব্যাটারির জন্য পরবর্তী প্রজন্মের অ্যানোড সামগ্রী প্রকৌশলী করার জন্য একটি শক্তিশালী পদ্ধতি। বাণিজ্যিক LIB-তে কার্যকরী অ্যানোড হিসাবে বর্ণিত উপকরণগুলিকে ব্যবহার করার জন্য, বিশেষত EV অ্যাপ্লিকেশনগুলির জন্য, তবে আরও গবেষণার প্রয়োজন। প্রকৃতপক্ষে, ন্যানোসাইজড পদার্থের বৃহৎ পরিসরে সংশ্লেষণের জন্য সস্তা বানোয়াট প্রক্রিয়াগুলির বিকাশের সাথে একসাথে উচ্চ শক্তি এবং উচ্চ শক্তির ঘনত্ব উভয়ই অর্জন করা প্রয়োজন। তদ্ব্যতীত, ইলেক্ট্রোড/ইলেক্ট্রোলাইট ইন্টারফেসে ইলেকট্রন পরিবহন বৈশিষ্ট্য সহ বর্ণিত উপকরণগুলির লিথিয়াম এবং ন্যানোসাইজড ফর্মগুলির মধ্যে মিথস্ক্রিয়া নিয়ন্ত্রণকারী প্রক্রিয়াগুলির তদন্ত ন্যানো প্রযুক্তি দ্বারা প্রকৌশলী পরবর্তী প্রজন্মের অ্যানোড সক্রিয় পদার্থের নকশার জন্য অত্যন্ত গুরুত্বপূর্ণ। .
লিথিয়াম কোষে বর্তমানে নিযুক্ত নেতিবাচক ইলেক্ট্রোডগুলি কার্বনের একটি ফর্মের মধ্যে লিথিয়ামের একটি কঠিন সমাধান জড়িত। লিথিয়াম কোষ যা লিথিয়ামের গলনাঙ্কের উপরে তাপমাত্রায় কাজ করে তাদের অবশ্যই মৌলিক লিথিয়ামের পরিবর্তে সংকর ধাতু ব্যবহার করতে হবে। এগুলি সাধারণত বাইনারি বা ত্রিনারি ধাতব পর্যায়। ইলেক্ট্রোড ভলিউম হ্রাস করার পাশাপাশি উল্লেখযোগ্যভাবে বর্ধিত ক্ষমতা অর্জনের লক্ষ্যে পরিবেষ্টিত তাপমাত্রায় কার্বনের পরিবর্তে ধাতব সংকর ধাতু ব্যবহারের সম্ভাবনার বিষয়েও বর্তমান আগ্রহ বাড়ছে। [রবার্ট এ. হাগিন্স, অ্যাডভান্সড ব্যাটারি, ম্যাটেরিয়ালস সায়েন্স অ্যাসপেক্টস, স্প্রিংগার, নিউ ইয়র্ক, 2009, পৃ.123]।
গ্রাফাইট অ্যামফোটেরিক, এবং গ্রাফিন স্তরগুলির মধ্যে এটিতে ক্যাটেশন বা অ্যানিয়ন ঢোকানো যেতে পারে। যখন ক্যাটেশন ঢোকানো হয়, হোস্ট গ্রাফাইট গঠন একটি ঋণাত্মক চার্জ গ্রহণ করে। Cation উদাহরণ হল Li + , K + , Rb + , এবং Cs + । যখন অ্যানিয়ন ঢোকানো হয়, হোস্ট গ্রাফাইট গঠন একটি ধনাত্মক চার্জ গ্রহণ করে এবং অ্যানিয়ন উদাহরণগুলি হল Br − ,SO2 – , SbF6 –
কার্বনে ক্ষারীয় ধাতুর সন্নিবেশ প্রথম 1926 সালে প্রদর্শিত হয়েছিল [K. ফ্রেডেনহেগেন এবং জি. ক্যাডেনবাচ, জেড অ্যানরগ। Allg. কেম। 158, 249 (1926)] এবং লিথিয়াম-কার্বনের রাসায়নিক সংশ্লেষণ 1955 সালে প্রদর্শিত হয়েছিল [ D. Guerard, A. Herold, Carbon 13, 337 (1975 )]। এক্স-রে ফটোইমিশন স্পেকট্রোস্কোপি পরীক্ষায় দেখা গেছে যে ঢোকানো লিথিয়াম তার ইলেকট্রনকে কার্বনে ছেড়ে দেয় এবং এইভাবে কাঠামোটিকে গ্রাফাইট কাঠামোর কার্বন স্তরগুলির মধ্যে থাকা Li + আয়ন হিসাবে দেখা যেতে পারে।
[জিকে ওয়ারথেইম, পিএমটিএইচ.এম. ভ্যান আটেকুম এবং এস বসু, সলিড স্টেট কমিউন। 33, 1127 (1980)]। গ্রাফাইটে প্রজাতির সন্নিবেশের প্রাথমিক কাজের একটি সাধারণ পর্যালোচনা পাওয়া যাবে
[এলবি এবার্ট, গ্রাফাইটের ইন্টারক্যালেশন যৌগ, উপকরণ বিজ্ঞানের বার্ষিক পর্যালোচনায়,
ভলিউম 6, এড. RA Huggins, Annual Reviews, Palo Alto, CA (1976), p. 181]।
অ্যানোড উপাদানের বিশুদ্ধতার গুরুত্বপূর্ণ ফ্যাক্টর হল পৃষ্ঠের যেকোনো অক্সিজেন-ধারণকারী প্রজাতিকে নির্মূল করার প্রয়োজন কারণ এগুলি ইলেক্ট্রোলাইটের সাথে বিক্রিয়া করবে। এই প্রতিক্রিয়া প্রতিরোধ করার জন্য, নির্মাতারা গ্রাফাইটকে 1100ºC) হ্রাসকারী বা জড় বায়ুমণ্ডলে বেক করে। এটি গ্রাফাইটের তুলনায় অন্যান্য ব্যবহারের জন্য খরচ বাড়ায়। অ্যানোড পেস্ট বা স্লারি তৈরি করতে কার্বন (90%) অন্যান্য উপাদানের সাথে মিশ্রিত করা হয়। ক্যাথোডের মতো, পলিভিনিলাইডেন ফ্লোরাইড (PVDF) একটি বাইন্ডার (-5%) হিসাবে ব্যবহৃত হয় এবং পরিবাহিতা নিশ্চিত করতে অল্প পরিমাণে কার্বন কালো যোগ করা হয়। উপরন্তু, n-মিথাইল পাইরোলিডোন (NMP) একটি অভিন্ন মিশ্রণ তৈরি করতে উপকরণগুলিকে দ্রবণ করতে ব্যবহৃত হয়। চাপ অভিন্ন শস্য আকার নিশ্চিত করে (স্যান্ডি 1999)।
লিথিয়াম টাইটানেট (LTO) অনেক আগ্রহ অর্জন করছে। LTO কোষগুলি অন্যান্য রসায়নের তুলনায় কম তাপমাত্রায় কাজ করে এবং উচ্চ শক্তির ঘনত্ব অফার করে। যাইহোক, এই ধরনের কোষগুলি প্রতি কক্ষে প্রায় 2.2-2.3 V এর পরিসরে নামমাত্র ভোল্টেজ কম থাকার কারণে ভোগে। [নোরিও তাকামি, হিরোকি ইনাগাকি, ইয়োশিনাও তাতেবায়াশি, হিদেসাতো সারুওয়াতারি, কেইজোহ হোন্ডা, শুন এগুসা, জে পাওয়ার সোর্স 244 (2013) 469-475]
ইলেক্ট্রোড উপাদান, সাধারণত গ্রাফাইট, চার্জিং প্রক্রিয়া চলাকালীন 10% দ্বারা প্রসারিত হয়। লিথিয়াম আয়ন ডিন্টারক্যালেট করলে গ্রাফাইট তার আসল আয়তন ফিরে পায়। যদি অ্যালুমিনিয়াম ব্যবহার করা হয় তবে লিথিয়াম আয়নগুলিকে শুধুমাত্র গ্রাফাইটের মধ্যে আন্তঃসংযোগ করা হবে না বরং কন্ডাকটরে ঢোকানো হবে, এইভাবে একটি অ্যালুমিনিয়াম-লিথিয়াম সংকর ধাতু তৈরি হবে। বিপরীত প্রক্রিয়া নিষ্কাশন সময় ঘটবে. অ্যালুমিনিয়াম কয়েক চক্রের পরে ক্ষয়প্রাপ্ত হবে এবং বর্তমান সংগ্রাহক হিসাবে অকেজো হয়ে যাবে।
যাইহোক, যদি গ্রাফাইটের পরিবর্তে লিথিয়াম টাইটানেট থেকে নেতিবাচক ইলেক্ট্রোড তৈরি করা হয়, তবে পরিস্থিতি নাটকীয়ভাবে পরিবর্তিত হয়। Li 4 Ti 5 O 12 এর ইলেক্ট্রোড সম্ভাবনা গ্রাফাইটের তুলনায় প্রায় 1.4 V বেশি (সেলের ভোল্টেজ প্রায় 1.4 V কম, 3.6 V এর বিপরীতে 2.2 V)। এটি লিথিয়াম আয়নগুলিকে অ্যালুমিনিয়ামের মধ্যে আন্তঃকলান হতে বাধা দেবে। অতএব, খরচ-সম্পর্কিত এবং ওজন-সম্পর্কিত কারণে তামার চেয়ে অ্যালুমিনিয়াম পছন্দ করা হয়। Li 4 Ti 5 O 12 প্রধানত স্থির অ্যাপ্লিকেশনে নিযুক্ত করা হয় কারণ এর নিম্ন সেল ভোল্টেজ। [ Călin Wurm et al., in Lithium-Ion Batteries, Reiner Korthauer (ed), মাইকেল Wuest et.al. দ্বারা অনুবাদিত, স্প্রিংগার, 2018। pp. 57 ]।
লিথিয়াম টাইটানেট উৎপাদনের প্রক্রিয়া: টাইটানিয়াম ডাই অক্সাইড এবং একটি লিথিয়াম যৌগের মিশ্রণ (এগুলির মধ্যে যে কোনও একটি: লিথিয়াম কার্বনেট, লিথিয়াম হাইড্রোক্সাইড, লিথিয়াম নাইট্রেট এবং লিথিয়াম অক্সাইড) 670 ডিগ্রি সেলসিয়াস থেকে 800 ডিগ্রি সেলসিয়াসের মধ্যে তাপমাত্রায় প্রি-সিন্টার করা হয়। . TiO 2 , এবং Li 2 TiO 3 নিয়ে গঠিত একটি যৌগ বা TiO 2 , Li 2 TiO 3 , এবং Li 4 Ti 5 O 12 নিয়ে গঠিত একটি যৌগ প্রাপ্ত হয়। তারপর যৌগটি 800 থেকে 950 ডিগ্রি সেন্টিগ্রেডের তাপমাত্রায় সিন্টার করা হয়। [তেতসুয়া ইয়ামাওয়াকি ইত্যাদি, ইউএস পেটেন্ট 6,645,673 B2, 2003 তোহো টাইটানিয়াম কোং, লিমিটেড, চিগাসাকিকে দেওয়া হয়েছে]
তোশিবার SCiB™ রিচার্জেবল ব্যাটারি (https://www.scib.jp/en/)
SCiB™ নিরাপত্তা, দীর্ঘ জীবন, নিম্ন-তাপমাত্রার কর্মক্ষমতা, দ্রুত চার্জিং, উচ্চ ইনপুট/আউটপুট শক্তি এবং বড় কার্যকর ক্ষমতা অর্জনের জন্য তার অ্যানোডে লিথিয়াম টাইটানিয়াম অক্সাইড (LTO) ব্যবহার করে। SCiB™ অটোমোবাইল, বাস, রেলগাড়ি, লিফট এবং পাওয়ার প্ল্যান্ট সহ যানবাহন, শিল্প এবং অবকাঠামোগত অ্যাপ্লিকেশনগুলিতে ব্যাপক অ্যাপ্লিকেশন খুঁজে পেয়েছে।
লিথিয়াম আয়ন ব্যাটারি বিভাজক উত্পাদন
দুটি ধরণের প্রক্রিয়া উপলব্ধ: ভিজা এবং শুকনো। জাপানি নির্মাতারা একটি ভেজা প্রক্রিয়া ব্যবহার করে যাতে পলিমার তেলে দ্রবীভূত হয়। তারপরে তেলটি বাষ্পীভূত হয়ে একটি ছিদ্রযুক্ত ফিল্ম ছেড়ে যায়। সেলগার্ড তৈরির জন্য তারা অতি উচ্চ আণবিক ওজনের পলিমার ব্যবহার করে, পলিমার গঠন নিয়ন্ত্রণ করতে গলনাঙ্কের নীচে ব্লোন পলিমার ফিল্মের তিনটি স্তর স্তরিত, টানা এবং অ্যানিল করা হয়। শীট তারপর দ্রুত porosity প্রাপ্ত করার জন্য প্রসারিত হয়.
দুটি ধরণের প্রক্রিয়া উপলব্ধ: ভিজা এবং শুকনো। জাপানি নির্মাতারা একটি ভেজা প্রক্রিয়া ব্যবহার করে যাতে পলিমার তেলে দ্রবীভূত হয়। তারপর তেলটি বাষ্পীভূত হয়ে একটি ছিদ্রযুক্ত ফিল্ম ছেড়ে যায়। সেলগার্ড তৈরির জন্য তারা অতি উচ্চ আণবিক ওজনের পলিমার ব্যবহার করে, পলিমার গঠন নিয়ন্ত্রণ করতে গলনাঙ্কের নীচে ব্লোন পলিমার ফিল্মের তিনটি স্তর স্তরিত, টানা এবং অ্যানিল করা হয়। শীট তারপর দ্রুত porosity প্রাপ্ত করার জন্য প্রসারিত হয়.
[পেকালা, আরডব্লিউ, এট আল।, 2000, “বিভাজক: ব্যাটারির কর্মক্ষমতা বাড়াতে একটি উপেক্ষিত সুযোগ?” 17 তম আন্তর্জাতিক সেমিনার এবং প্রাথমিক ও মাধ্যমিক ব্যাটারির প্রদর্শনী, Ft. Lauderdale, Fla., মার্চ 6-9]
এই প্রক্রিয়াটি অপারেটিং অবস্থার জন্য খুবই সংবেদনশীল এবং এমনকি উপাদান ব্যাচের সাথেও পরিবর্তিত হয়, তাই সতর্ক নিয়ন্ত্রণ প্রয়োজন [লিন্ডা গেইনস এবং রয় কুয়েনকা, যানবাহনের জন্য লিথিয়াম আয়ন ব্যাটারির খরচ, ANL রিপোর্ট ANL/ESD-42, মে 2000, pp. 20] .
যাইহোক, EV/HEV কোষগুলির জন্য বিভাজকগুলিতে প্রয়োজনীয় অতিরিক্ত বেধ হ্রাস শক্তির জন্য ক্ষতিপূরণ দেয়। [ওয়াই। নিশি, in: M. Wakihara, O. Yamamoto (Eds.), Lithium Ion Batteries, Wiley/VCH/Kodansha, Tokyo, 1998, p. 195।
পি অরোরা, জেড ঝাং, কেম। রেভ. 104 (2004) 4419]।
ভাল যান্ত্রিক শক্তি, ইলেক্ট্রোলাইট ব্যাপ্তিযোগ্যতার মতো প্রচলিত বৈশিষ্ট্যগুলি ছাড়াও, এই মাইক্রো ছিদ্র বিভাজকগুলি কোষের অপব্যবহারের সময় একটি প্রতিরক্ষামূলক বৈশিষ্ট্য প্রদর্শন করে। উদাহরণস্বরূপ, যদি অতিরিক্ত অতিরিক্ত চার্জের কারণে কোষের তাপমাত্রা অস্বাভাবিকভাবে বেড়ে যায়, উদাহরণস্বরূপ, উত্পন্ন তাপ PE-কে নরম করে এবং ফিল্মের মাইক্রোপোরগুলি বন্ধ করে দেয়। একে বিভাজক “শাটডাউন” বলা হয়। একবার বন্ধ হয়ে গেলে, ইলেক্ট্রোডের মধ্যে আয়নিক পরিবহন কার্যকরভাবে বন্ধ হয়ে যায় এবং কারেন্ট প্রবাহ বন্ধ হয়ে যায়। যদি বিভাজক তার শাটডাউন তাপমাত্রার উপরে যান্ত্রিক অখণ্ডতা ধরে রাখতে পারে, তবে এটি ডিভাইসটিকে নিরাপত্তার একটি মার্জিন প্রদান করতে পারে; অন্যথায়, ইলেক্ট্রোড সরাসরি সংস্পর্শে আসতে পারে, রাসায়নিকভাবে বিক্রিয়া করতে পারে, যা তাপীয় পলাতক হতে পারে।
যাইহোক, এটা সম্ভব যে তাপীয় জড়তার কারণে শাটডাউনের পরেও তাপমাত্রা বাড়তে পারে। এই ধরনের পরিস্থিতিতে বিভাজক ইলেক্ট্রোডগুলিকে গলিয়ে ছোট করবে, যার ফলে হিংসাত্মক প্রতিক্রিয়া এবং তাপ উৎপন্ন হবে। এই ঘটনাটিকে বিভাজকের “মেল্টডাউন” বা “ব্রেকডাউন” বলা হয়। অতএব, ঘরের নিরাপত্তা নিশ্চিত করার জন্য, “শাটডাউন” এবং “মেল্টডাউন” তাপমাত্রার মধ্যে পার্থক্য যতটা সম্ভব বড় হওয়া উচিত।
সম্পূর্ণ উচ্চ-ঘনত্বের পলিথিন দিয়ে তৈরি বিভাজক 135°C এ গলে যায় এবং এই তাপমাত্রার উপরে যান্ত্রিক অখণ্ডতা হারায়। যাইহোক, পলিপ্রোপিলিন এবং পলিথিনের স্তরিত স্তর দ্বারা তৈরি বিভাজকগুলি অন্তত 165°C পর্যন্ত যান্ত্রিক অখণ্ডতা বজায় রাখে, পলিপ্রোপিলিনের গলনাঙ্ক। এটি লক্ষ্য করা আকর্ষণীয় যে যদিও অতি উচ্চ আণবিক ওজনের পলিথিন 135°C এ গলে যায়, এই উপাদান থেকে তৈরি বিভাজকগুলি তাদের যান্ত্রিক অখণ্ডতা কমপক্ষে 180°C পর্যন্ত ধরে রাখে কারণ উপাদানটির সান্দ্রতা এমন যে এটি শারীরিক অখণ্ডতা বজায় রাখে।
শাটডাউন বিভাজক নির্ভরযোগ্য এবং লিথিয়াম-আয়ন ব্যাটারি নির্মাতারা ক্রমবর্ধমানভাবে তাদের পণ্যগুলিতে তাদের অন্তর্ভুক্তির জন্য বেছে নিচ্ছে। সবচেয়ে সাধারণ শাটডাউন বিভাজকগুলিতে উচ্চ আণবিক ওজনের পলিপ্রোপিলিন সুপার-হাই মলিকুলার ওয়েট পলিথিনের সাথে মিশ্রিত থাকে। এখানে, পলিথিনের অনন্য শাটডাউন সম্পত্তি উন্নত তাপমাত্রায় পলিপ্রোপিলিনের উচ্চ যান্ত্রিক অখণ্ডতার সাথে অনুকূলভাবে মিলিত হয়। যেহেতু শাটডাউন অপরিবর্তনীয়, একবার সক্রিয় হয়ে গেলে, এই বিভাজক কোষগুলিকে স্থায়ীভাবে ক্ষতিগ্রস্থ করে। [পিজি বালাকৃষ্ণান, আর. রমেশ, টি. প্রেম কুমার , জে. পাওয়ার সোর্স। 155 (2006) 401-414]
লিথিয়াম আয়ন ব্যাটারিতে অন্যান্য উপকরণ
বর্তমান সংগ্রাহক যেমন অ্যালুমিনিয়াম, নিকেল এবং কপার ফয়েল , বাইন্ডার যেমন এস টাইরিন-বুটাডিয়ান কপোলিমার (এসবিআর), এবং পি অলিভিনিলাইডেন ফ্লোরাইড (পিভিডিএফ), ইলেক্ট্রোলাইট এবং দ্রাবক, ক্যাথোড পরিবাহী সংযোজন, বিভাজক।
লিথিয়াম-আয়ন ব্যাটারির সুবিধা এবং সীমাবদ্ধতা - লিথিয়াম আয়ন কোষ উত্পাদন
অ্যানোড থেকে ক্যাথোড ওজনের অনুপাত
এটা খুবই গুরুত্বপূর্ণ যে সেল অপারেশনের সময় কোন লিথিয়াম ধাতু তৈরি না হয়। ধাতু জমা হয়ে ডেনড্রাইট তৈরি করে যা কোষকে অভ্যন্তরীণভাবে ছোট করে। চার্জিংয়ের সময় ভোল্টেজ নিয়ন্ত্রণ এবং সেল ব্যালেন্স এই সমস্যাটিকে অনেকাংশে কমাতে সাহায্য করে। লিথিয়াম জমা নিয়ন্ত্রণের প্রধান পদ্ধতি হল কোষের পৃথক প্লেটের ক্যাথোড ক্ষমতার সাথে অ্যানোডের অনুপাত। অ্যানোড ইলেক্ট্রোডের ক্যাথোডের তুলনায় প্রায় 10% বেশি ব্যবহারযোগ্য ক্ষমতা রয়েছে। এটি চার্জের সময় অ্যানোডে লিথিয়াম ধাতব জমা হওয়া প্রতিরোধ করে, কারণ ক্যাথোড কোষের ক্ষমতা নির্ধারণ করে। লিথিয়াম ধাতু ইলেক্ট্রোড পৃষ্ঠে জমা হলে, এটি ইলেক্ট্রোলাইটের সাথে বিক্রিয়া করে এবং তাপীয় পলায়ন শুরু করতে পারে।

চিত্র 21। লিথিয়াম আয়ন কোষে অ্যানোড এবং ক্যাথোড ক্ষমতার অনুপাত
( ক্রেডিট: Ralph J. Brodd এবং Kazuo Tagawa, In Advances in Lithium-Ion Batteries, Walter A. Van Schalkwijk এবং Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 272, 2002.)
লিথিয়াম আয়ন কোষ সমাবেশ প্রক্রিয়া
একটি লিথিয়াম আয়ন ব্যাটারির জন্য সেল অ্যাসেম্বলি প্রক্রিয়াগুলির জন্য সক্রিয় উপাদানের সাথে প্রলিপ্ত ইতিবাচক এবং নেতিবাচক ইলেক্ট্রোড স্টক প্রলেপ করার সময় স্পষ্টতা এবং নির্ভুলতার প্রয়োজন হয়। আবরণ প্রক্রিয়া উচ্চ ক্ষমতা, উচ্চ-নির্ভরযোগ্যতা পণ্য নিশ্চিত করার জন্য একটি গুরুত্বপূর্ণ উপাদান। যদি আবরণগুলি নিম্নমানের হয় তবে শুধুমাত্র নিম্ন-কার্যক্ষমতা সম্পন্ন ব্যাটারি তৈরি করা হবে। সক্রিয় ভর প্রস্তুতির প্রাথমিক ধাপগুলি ফলাফল নির্ধারণ করে।
কোহেন এবং গুটফ [ই। কোহেন এবং ই. গুটফ, আধুনিক আবরণ এবং শুকানোর প্রযুক্তি, উইলি-ভিসিএইচ,
নিউ ইয়র্ক, 1992] আবরণ স্লারির রিওলজি, প্রয়োজনীয় নির্ভুলতা এবং আবরণের গতির উপর ভিত্তি করে একটি নির্দিষ্ট প্রয়োগের জন্য সর্বোত্তম আবরণ কৌশলে পৌঁছানোর একটি পদ্ধতি বর্ণনা করুন।

চিত্র 22। অ্যানোড এবং ক্যাথোড আবরণ প্রক্রিয়া
( ক্রেডিট: Ralph J. Brodd এবং Kazuo Tagawain in Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk এবং Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 273, 2002।)
লিথিয়াম আয়ন ব্যাটারি তৈরির জন্য ফ্লো চার্ট

চিত্র 23। লিথিয়াম আয়ন কোষ তৈরির জন্য ফ্লো চার্ট
[রাল্ফ জে. ব্রড এবং কাজুও তাগাওয়া লিথিয়াম-আয়ন ব্যাটারিতে অগ্রগতি, ওয়াল্টার এ. ভ্যান শাল্কউইজক এবং ব্রুনো স্ক্রোসাটি (এডস.), ক্লুওয়ার একাডেমিক পাবলিশার্স, নিউ ইয়র্ক, পৃ. 271, 2002।]

ক্রেডিট: Electropaedia https://www.mpoweruk.com/battery_manufacturing.htm
চিত্র 24। কাঁচামাল থেকে ইলেক্ট্রোড তৈরির জন্য ফ্লো চার্ট
লিথিয়াম আয়ন কোষ সমাবেশ




লিথিয়াম আয়ন ব্যাটারি নির্মাতারা কোষ একত্রিত করার সময় নিম্নলিখিত পয়েন্টগুলিতে লক্ষ্য রাখে:
- লিথিয়াম আয়ন কোষের নকশার ফলে ইলেক্ট্রোড এলাকা জুড়ে অভিন্ন বর্তমান ঘনত্ব হতে হবে।
- সক্রিয় উপকরণ (AM) এবং বর্তমান সংগ্রাহকের মধ্যে ভাল যোগাযোগ নিশ্চিত করতে
- বৃহৎ পৃষ্ঠ এলাকা ইলেক্ট্রোড কোষ উচ্চ হার কর্মক্ষমতা দিতে নিযুক্ত করা হয়. এটি ইলেক্ট্রোড বিক্রিয়ার গতিবিদ্যার কারণে মেরুকরণ, অর্থাৎ ভোল্টেজের ক্ষতি হ্রাস করে এবং বিভাজক জুড়ে ভোল্টেজ ড্রপকে কমিয়ে দেয়।
ছিদ্রের গঠন এবং পরিবাহী কার্বনের সংমিশ্রণ সক্রিয় উপাদানের ভাল আন্তঃকণা যোগাযোগ দেয়।
সক্রিয় পদার্থ, পরিবাহী কার্বন এবং বর্তমান সংগ্রাহকের মধ্যে ভাল যোগাযোগ অপরিহার্য, সক্রিয় পদার্থের সম্পূর্ণ ব্যবহারের জন্য এবং উচ্চ হারের কার্যক্ষমতার সময় ভাল দক্ষতার জন্য।
কোবাল্ট ক্যাথোড মিশ্রণ LiCoO2 (একটি কালো পাউডার) + PVdF বাইন্ডার (একটি সাদা আধা-ক্রিস্টালাইন ফ্লুরোপলিমার থার্মোপ্লাস্টিক) + দ্রাবক হিসাবে N-মিথাইল পাইরোলিডোন (NMP, একটি বর্ণহীন জৈব তরল) থেকে প্রস্তুত করা হয়। LICoO2 অ-পরিবাহী হওয়ায়, একটি পরিবাহী তরল, সর্বদা একটি কার্বন কালো, LiCoO2 এর পরিবাহিতা বাড়াতে যোগ করা হয়।
উপকরণের অনুপাত এবং পরিমাণ সেল ডিজাইন এবং মিক্সারের আকার দ্বারা নির্ধারিত হয়। আবরণ দ্রাবক এবং বাইন্ডার যুক্ত করার আগে অ-পরিবাহী সক্রিয় উপাদান এবং কার্বনকে শুষ্ক করার জন্য একটি নিবিড় মিশ্রণ পদ্ধতি ব্যবহার করা হয়।
পরিবাহী কার্বনের একটি পাতলা ফিল্মের সাথে সক্রিয় উপাদানের কণাগুলির একটি অভিন্ন আবরণ দেওয়ার জন্য মিশ্রণটি শুকনো মিশ্রিত হয় যাতে AM এবং বর্তমান সংগ্রাহক গ্রিডের (অ্যালুমিনিয়াম ফয়েল, 20 মিমি পুরুত্ব) মধ্যে বৈদ্যুতিক যোগাযোগ উন্নত হয়, এইভাবে সমস্ত AM এর সম্পূর্ণ ব্যবহার নিশ্চিত করা। পলিমার NMP একটি পৃথক পাত্রে আবরণ দ্রাবক মধ্যে দ্রবীভূত করা হয়. শুষ্ক মিশ্রণ মিশ্রণ এবং দ্রাবক দ্রবণকে একত্রিত করে একটি স্লারি তৈরি করা হয়।
দ্রাবক সংযোজন আবরণ অপারেশনের জন্য স্লারি (বা পেইন্ট) এর সান্দ্রতা সামঞ্জস্য করতে ব্যবহৃত হয় । Polyvinylenedifluoride (PVdF) হল পছন্দের বাইন্ডার এবং দ্রাবক হল N-methylpyrollidinone (NMP)। মিক্সিং অপারেশন থেকে স্লারি সিল করা পাত্রে স্থাপন করা হয়, যা আবরণ অপারেশনের জন্য জলাধার এবং স্থানান্তর মাধ্যম হিসাবে কাজ করে। আবরণের মাথায় যাওয়া তরলটিতে বাতাসের প্রবেশ এড়াতে গিয়ার পাম্প বা অনুরূপ নির্ভুল পাম্প সহ স্টোরেজ কন্টেইনার থেকে সুনির্দিষ্ট পরিমাণে আবরণ স্লারি পাম্প করা হয়।
অ্যানোড মিশ্রণটি হার্ড কার্বন, পিভিডিএফ বাইন্ডার এবং এনএমপি দিয়ে একইভাবে প্রস্তুত করা হয়। এই মিশ্রণটি গ্রিড হিসাবে ব্যবহৃত একটি তামার ফয়েলের উপর লেপা হয় (10 মিমি পুরুত্ব)।
অ্যানোড এবং ক্যাথোড উভয়ের জন্য প্রায় 100 মিমি পুরুত্বের উভয় পাশে আবরণ করা হয়। আবরণের পুরুত্ব হ্রাস করে কোষের একটি নির্দিষ্ট আয়তনের জন্য মোট পৃষ্ঠের ক্ষেত্রফলের বৃদ্ধি পাওয়া যায়। ব্যবহৃত জৈব ইলেক্ট্রোলাইটগুলি জলীয়গুলির তুলনায় কম পরিবাহিতা ধারণ করে এবং তাই এই উচ্চতর পৃষ্ঠের ক্ষেত্রটি একটি উচ্চ শক্তির স্রাব কোষের জন্য সহজতর করবে।
ইলেক্ট্রোড বেধ সর্বোচ্চ শক্তি প্রয়োজনীয় উপর নির্ভর করে. লিথিয়াম আয়ন ব্যাটারি উত্পাদন প্রযুক্তির একটি অনন্য বৈশিষ্ট্য হল যে এটি একই ইলেক্ট্রোড উত্পাদন প্রযুক্তির সাথে বিস্তৃত শক্তি/শক্তি/শক্তি অনুপাত ডিজাইনের অনুমতি দেয়। [ব্রাউসলি, নাজরী পৃষ্ঠা 651]। কিন্তু উপযুক্ত বর্তমান সংগ্রহ এবং ট্যাবিং, কোষের আকার এবং নকশা গুরুত্বপূর্ণ।
কোষ সমাবেশ: প্রলিপ্ত ফয়েল দ্রাবককে বাষ্পীভূত করতে একটি চুলার মধ্য দিয়ে যায় এবং ফয়েলের উপর একটি সুনির্দিষ্ট পরিমাণ সক্রিয় ভর রেখে যায়। অনেক আবরণ দ্রাবক বিপজ্জনক হিসাবে শ্রেণীবদ্ধ করা হয় এবং বায়ুমণ্ডলে ছেড়ে দেওয়া যায় না। একটি খরচ-সঞ্চয় পরিমাপ হিসাবে, দ্রাবক সাধারণত প্রক্রিয়ায় পুনঃব্যবহারের জন্য পুনরুদ্ধার করা হয়। পরিবেশের কোনো দূষণ এড়াতে দ্রাবককে পুড়িয়ে ফেলা হতে পারে।
বেশিরভাগ লিথিয়াম আয়ন কোষের আকৃতি নলাকার। প্রিজম্যাটিক কোষের উপাদান পেতে জেলি রোলটি চ্যাপ্টা করা হয়।
প্রিজম্যাটিক কোষগুলি আরও ভাল ভলিউম পূরণের জন্য অনুকূল, তবে সাইকেল চালানো বা বার্ধক্যের জন্য দায়বদ্ধ। নলাকার সেল ক্যানগুলি আরও ভাল যান্ত্রিক শক্তি, ভাল মাত্রিক স্থিতিশীলতা এবং উপাদানগুলিতে অভিন্ন চাপ সরবরাহ করে।
আবরণ অপারেশন কয়েলের দৈর্ঘ্যের সাথে মেলে বিঘ্নিত আবরণ তৈরি করে। উইন্ডিং মেশিনগুলি ক্যাথোড এবং অ্যানোডের শুকনো জাম্বো রোল এবং বিভাজক (25 মিমি বা কম বেধ, পিপি বা পিই বা মিশ্রিত) দিয়ে স্বয়ংক্রিয়ভাবে কাজ করার জন্য ডিজাইন করা হয়েছে।
ফয়েলগুলির আবরণহীন অংশে ট্যাবগুলিকে ঢালাই করে কাজগুলি শুরু হয়। উইন্ডিং মেশিন তারপরে স্ট্রিপটিকে সঠিক দৈর্ঘ্যে কাটে এবং অ্যানোড-সেপারেটর-ক্যাথোডের সংমিশ্রণটিকে জেলিরল ফ্যাশনে একটি টাইট কয়েল বা ববিনে বায়ু করে। ক্ষত কোরের ব্যাস বৃদ্ধির সাথে সাথে, উইন্ডিং মেশিন স্বয়ংক্রিয়ভাবে ধ্রুবক টান বজায় রাখতে ক্ষতিপূরণ দেয় কারণ ব্যাসের উপর ঘনিষ্ঠ সহনশীলতার জন্য কয়েলটি ব্যাস বৃদ্ধি পায়। প্রিজম্যাটিক কোষগুলির জন্য উপবৃত্তাকার বায়ু একটি আরও জটিল এবং ধীর প্রক্রিয়া।
ঘুরানোর পরে, ক্যানের মধ্যে ঢোকানোর আগে কুণ্ডলীটি অভ্যন্তরীণ শর্টগুলির জন্য পরীক্ষা করা হয়। স্টিলের ক্যানগুলি পরিষ্কার এবং নিকেল-ধাতুপট্টাবৃত হওয়া উচিত যাতে একটি স্থিতিশীল পৃষ্ঠ সরবরাহ করা যায় এবং কোষ সমাবেশের আগে ক্ষয় কম করা যায়। অ্যানোড সীসা ক্যানের নীচে ঝালাই করা হয় এবং ক্যাথোড সীসা নিরাপত্তা ভেন্টে ঢালাই করা হয়। অর্ধ-একত্রিত কোষে ইলেক্ট্রোলাইট যোগ করা হয়। সমাবেশ শীর্ষ কভার এর crimping সঙ্গে সমাপ্ত হয়.
সম্ভাব্য কোষের ত্রুটিগুলির প্রাথমিক প্রত্যাখ্যান একটি অর্থনৈতিক পরিমাপ এবং খারাপ কোষগুলিতে আরও কাজকে বাধা দেয়। ববিনটি ক্যানের মধ্যে ঢোকানো হয় যাতে ক্যানটি উপাদানটির উপাদানগুলিকে কাছাকাছি ধরে রাখার জন্য ধ্রুবক চাপ সরবরাহ করে, এইভাবে তাদের মধ্যে শূন্যতার সুযোগ দূর করে। কিছু নির্মাতারা কয়েলের কেন্দ্রকে স্থিতিশীল করতে একটি ম্যান্ড্রেল সন্নিবেশ করতে পারে।
সমস্ত ক্রিয়াকলাপগুলি একটি শুষ্ক ঘরে বা শুষ্ক বাক্সে সঞ্চালিত না হলে, ইলেক্ট্রোলাইট ভর্তি প্রক্রিয়ার আগে সক্রিয় পদার্থের শোষিত জল অবশ্যই তাপ এবং ভ্যাকুয়াম দ্বারা অপসারণ করতে হবে।
ইলেক্ট্রোলাইটের নির্ভুল ভ্যাকুয়াম ফিলিং করা হয় তা নিশ্চিত করার জন্য যে ইলেক্ট্রোলাইট প্রবেশ করে এবং সম্পূর্ণরূপে বিভাজক এবং ইলেক্ট্রোড কাঠামোতে উপলব্ধ ছিদ্র পূরণ করে। নির্ভুলতা পাম্প ভাল সেল অপারেশনের জন্য প্রয়োজনীয় ইলেক্ট্রোলাইটের গণনাকৃত ভলিউম মিটার করে। অবিচ্ছিন্নভাবে সমস্ত নির্মাতারা ইলেক্ট্রোলাইট হিসাবে LiPF 6 (একটি অজৈব সাদা স্ফটিক যৌগ) ব্যবহার করে এবং চক্রাকার (EC, ইথিলিন কার্বনেট) বা রৈখিক কার্বনেট (DMC, ডাইমিথাইল কার্বনেট, DEC, ডাইথাইল কার্বনেট, বা EMC, ইথাইল-মিথাইল কার্বোনেট ইত্যাদি)। এই ইলেক্ট্রোলাইট লবণ জন্য দ্রাবক.
ডাইমিথাইল কার্বোনেট (ডিএমসি) এবং/অথবা ডাইথাইল কার্বনেট (ডিইসি) এর সাথে ইথিলিন কার্বোনেট (ইসি) এর দ্রাবক মিশ্রণের উপর ভিত্তি করে ইলেক্ট্রোলাইটগুলি সাধারণত “4 ভি” ক্যাথোডের সাথে লিথিয়াম আয়ন ব্যাটারির জন্য ব্যবহৃত হয় (কোবল্টেট, নিকলেট এবং ম্যাঙ্গানেট) কারণ দ্রাবক উচ্চ জারণ সম্ভাবনা.
ইলেক্ট্রোলাইট দিয়ে সেলটি পূরণ করার পরে, সেল ক্যান এবং উপরের প্লেটের মধ্যে স্থাপন করা পলিমার গ্যাসকেট বা গ্রোমেটের নিয়ন্ত্রিত কম্প্রেশন দ্বারা সেলটি সিল করা হয়। পলিমার গ্যাসকেট সিলের চাপ পলিমারের স্থিতিস্থাপক সীমার মধ্যে রাখতে নিয়ন্ত্রণ করা হয়। যদি ইলাস্টিক সীমা অতিক্রম করা হয়, পলিমার ঠান্ডা প্রবাহিত হয় এবং সীল আপস করে।
প্রতিটি প্রস্তুতকারক কোষগুলিকে সিল করার জন্য কিছুটা আলাদা যান্ত্রিক নির্মাণ ব্যবহার করে তবে চূড়ান্ত ফলাফলগুলি মূলত অভিন্ন। সাধারণত, কোষের শীর্ষের কাছে একটি কাঁধ বা লেজ গঠিত হয়। এটি সীলমোহরের ভিত্তি হিসাবে কাজ করে এবং জেলিরোলটিকে যথাস্থানে ধরে রাখে এবং কম্পন এবং শকের প্রভাবে ক্ষত ববিনের টেলিস্কোপিং বা পরিবর্তন রোধ করে।
অবস্থানের যেকোনো পরিবর্তন বর্তমান বন্টনের পরিবর্তন ঘটায় এবং এর ফলে উচ্চ-কর্মক্ষমতা কোষে দুর্বল চক্র জীবন বা লিথিয়াম প্লেটিং হয়। সেল টপ প্লেট সিলে একটি ভেন্ট, একটি ইতিবাচক তাপমাত্রা সহগ উপাদান (PTC) এবং একটি বর্তমান বাধা (CID) সুরক্ষা ডিভাইস রয়েছে। CID এবং PTC উভয়ই সুরক্ষা ডিভাইস যা সক্রিয় এবং বিপজ্জনক তাপমাত্রা এবং কোষের অভ্যন্তরীণ বিকাশ থেকে চাপ প্রতিরোধ করার জন্য ডিজাইন করা হয়েছে। শীর্ষ সমাবেশে অন্তর্ভুক্ত করার আগে প্রতিটি ডিভাইস সঠিক অপারেশনের জন্য পরীক্ষা করা হয়।
সীল লাগানোর পরে কোষগুলি ধুয়ে, জ্যাকেট করা এবং লেবেল করা যেতে পারে। উত্পাদনের দিন এবং কোষের সমস্ত উপাদান (ইলেকট্রোড সামগ্রী, ইলেক্ট্রোলাইট, বিভাজক এবং এর মতো) সনাক্ত করার জন্য তাদের একটি ক্রমিক নম্বর দেওয়া হয়। ক্ষমতা এবং ভোল্টেজ সম্পর্কিত তথ্য সেল নম্বরের সাথে সংরক্ষণ করা হয় এবং প্যাক সমাবেশের জন্য কোষের সাথে মেলে পরে ব্যবহার করা হয়।
দীর্ঘস্থায়ী হারমেটিক সীল সরবরাহ করতে কোষগুলিকে গ্লাস থেকে ধাতব সীল দিয়ে লেজার ঢালাই করা যেতে পারে। বৃহত্তর কোষগুলির সাথে, অপব্যবহারের অবস্থার মধ্যেও নিরাপদ অপারেশন নিশ্চিত করার জন্য আরও বেশি যত্ন নিতে হবে।
যদিও উপরের প্রক্রিয়াগুলি, পোর্টেবল ইলেকট্রনিক্সে ব্যবহৃত ছোট সিল করা কোষগুলির জন্য চিত্রিত করা হয়েছে, শক্তি সঞ্চয়স্থান, স্থান এবং EV অ্যাপ্লিকেশনগুলির জন্য বৃহত্তর শিল্প ব্যাটারির প্রক্রিয়া একই সাধারণ রূপরেখা অনুসরণ করে।
লিথিয়াম আয়ন ব্যাটারি - গঠন এবং বার্ধক্য
একত্রিত হিসাবে, লি আয়নগুলি অ্যানোড কার্বনে ডোপ করা হয় না এবং তাই কোষটি কোনও ভোল্টেজ দেখায় না। প্রাথমিক চার্জ করার সময়, PAM LiCoO 2 থেকে Li আয়নগুলির একটি অংশ Li 1-x CoO 2 হওয়ার জন্য আনডপ করা হয় এবং এই লিথিয়াম আয়নগুলিকে কার্বন অ্যানোডে (C y ) ডোপ করা হয় যাতে Li x C y হয়ে যায়। যখন চার্জিং ভোল্টেজ 4.1 থেকে 4.2 V এ পৌঁছায়, তখন x এর মান প্রায় 0.5 হয়। (অর্থাৎ, 50%) নির্দেশ করে যে LiCoO 2 থেকে 50% Li ব্যবহার করা হয়েছে।
আরেকটি দিক লক্ষ্য করা উচিত যে ডোপড লিথিয়াম আয়নগুলির একটি অংশ ফিরে আসে না এবং অ্যানোডে থাকে। যেখানে, x-dx লিথিয়াম আয়ন ক্ষমতায় অবদান না রেখেই থাকে। এটি প্রায় 10 থেকে 20% অপরিবর্তনীয় লিথিয়াম, যার অর্থ প্রাথমিক চার্জের কার্যকারিতা 80 থেকে 90%। দ্বিতীয় চক্র থেকে, অপরিবর্তনীয় পরিমাণ বৃদ্ধি পায় না এবং সেলটি প্রস্তুতকারকের দ্বারা ডিজাইন করা 100% ক্ষমতা দেখায়।
ওয়াশিং এবং জ্যাকেটিংয়ের পরে, কিন্তু গঠন প্রক্রিয়া শুরু করার আগে, সমস্ত কোষের ভোল্টেজ এবং প্রতিবন্ধকতা রেকর্ড করা হয় কোনো ত্রুটিপূর্ণ কোষগুলিকে সাজানোর জন্য। কোষগুলি প্রথমবার চার্জ করা হয়
(প্রাথমিক চার্জিং বা গঠন চার্জিং)। প্রথম চার্জের শর্তগুলি অন্তত দুটি কারণে গুরুত্বপূর্ণ:
1) সলিড ইলেক্ট্রোলাইট ইন্টারফেজ (SEI) স্তরটি অ্যানোডের উপর গঠন করে যাতে এটি স্বাভাবিক সেল অপারেশনের সময় ইলেক্ট্রোলাইটের সাথে স্বতঃস্ফূর্তভাবে প্রতিক্রিয়া করা থেকে রক্ষা করে এবং 2) এটি সক্রিয় পদার্থ এবং ইলেক্ট্রোলাইটের মধ্যে ভাল বৈদ্যুতিক যোগাযোগ স্থাপন করে। প্রথম চার্জটি কোষগুলিকে চার্জ করার জন্য প্রস্তুতকারকের প্রস্তাবিত পদ্ধতি অনুসরণ করে তবে প্রায়শই কম কারেন্ট থেকে শুরু হয় এবং তারপর চার্জের সময়ের প্রায় এক-তৃতীয়াংশ পথে স্বাভাবিক চার্জিং কারেন্টে বৃদ্ধি পায়। কোষগুলি গঠনের পরে আরও এক বা দুটি চক্রের জন্য চার্জ এবং স্রাবের জন্য ভোল্টেজ সীমার মধ্যে সাইক্লিং চালিয়ে যেতে পারে।
গঠন বা সাইক্লিংয়ের পরে, কোষের ভোল্টেজ এবং ক্ষমতা পরিমাপ করা হয় এবং কোষ নির্বাচন প্রক্রিয়ায় পরবর্তী ব্যবহারের জন্য সংরক্ষণ করা হয়। প্রস্তুতকারকের উপর নির্ভর করে বার্ধক্যের সময়কাল দুই সপ্তাহ থেকে এক মাসের মধ্যে পরিবর্তিত হয়। কোষের ভোল্টেজ সংরক্ষণের পরে আবার পরিমাপ করা হয়। স্টোরেজ পিরিয়ডের শুরুতে এবং শেষে ভোল্টেজের পার্থক্যগুলি “নরম-” বা “মাইক্রো-” শর্টস দিয়ে ঘর সাজানোর জন্য ব্যবহৃত হয়। অভ্যন্তরীণ শর্টস সহ কক্ষগুলির স্টোরেজের পরে কম ভোল্টেজ থাকবে এবং স্বাভাবিক ভোল্টেজ এবং ক্ষমতা বন্টন থেকে নিজেদের আলাদা করবে। গঠনের গ্যাসগুলি অপসারণের জন্য গঠনের পরে বৃহত্তর কোষগুলিকে খালি করার প্রয়োজন হতে পারে।
সমাবেশ প্রক্রিয়ার বিস্তারিত বিবরণের জন্য, পাঠকদের উল্লেখ করা হয়
- কাওরু নাকাজিমা এবং ইয়োশিও নিশি অধ্যায় 5: ইলেকট্রনিক্সের জন্য শক্তি স্টোরেজ সিস্টেম, এড তেতসুয়া ওসাকা এবং মাধব দত্ত, গর্ডন এবং রিচ সায়েন্স পাবলিশার্স, আমস্টারডাম, 2000।
- লিথিয়াম-আয়ন সেল উৎপাদন প্রক্রিয়া, রাল্ফ জে. ব্রড এবং কাজুও তাগাওয়া, অধ্যায় 9 ইন: লিথিয়াম-আয়ন ব্যাটারিতে অগ্রগতি, ওয়াল্টার এ. ভ্যান শাল্কউইক এবং ব্রুনো স্ক্রোসাটি (এডস), ক্লুওয়ার একাডেমিক পাবলিশার্স, নিউ ইয়র্ক, পৃষ্ঠা 273, 20202 .
- লিথিয়াম ব্যাটারি, বিজ্ঞান ও প্রযুক্তি, ed. GA Nazri এবং G. Pistoia, Springer, New York, 2009 দ্বারা।
- Lithium-Ion Batteries, Reiner Korthauer (ed) (2018), Michael Wuest et.al., Springer, 2018 দ্বারা অনুবাদিত।
- কাজুও তাগাওয়া এবং রাল্ফ জে. ব্রড, লিথিয়াম-আয়ন ব্যাটারিতে লিথিয়াম-আয়ন ব্যাটারি তৈরির জন্য উত্পাদন প্রক্রিয়া, ইয়োশিও এম., ব্রড আরজে, কোজাওয়া এ. (এডিস) স্প্রিংগার, নিউ ইয়র্ক, NY৷ https://doi.org/10.1007/978-0-387-34445-4_8]
- ঝাং জেড., রামাদাস পি. (2012) লিথিয়াম-আয়ন ব্যাটারি সিস্টেম এবং প্রযুক্তি। ইন: মেয়ার্স আরএ (এডি) টেকসই বিজ্ঞান ও প্রযুক্তির এনসাইক্লোপিডিয়া। স্প্রিংগার, নিউ ইয়র্ক। https://doi.org/10.1007/978-1-4419-0851-3_663
- দ্য হ্যান্ডবুক অফ লিথিয়াম-আয়ন ব্যাটারি প্যাক ডিজাইন রসায়ন, উপাদান, প্রকার এবং পরিভাষা, জন ওয়ার্নার, এলসেভিয়ার, 2018




