Come funziona la batteria agli ioni di litio
La percezione nel dominio pubblico è che le batterie al piombo sono una tecnologia vecchia. La batteria agli ioni di litio ha una percezione diversa, è moderna, più pulita, ha 3 o 4 volte la densità di energia e una vita di ciclo più lunga. Con tutto ciò, quali possibili vantaggi potrebbe apportare la tecnologia degli acidi al piombo, vecchia di 150 anni? Beh, in realtà, non è tutto come sembra, guardate dietro i titoli dei giornali i dati utilizzati nelle affermazioni di marketing, poi applicate un po’ di buon senso, la ricerca di base e qualche scienza rudimentale. Scoprirete che la vera storia è piuttosto diversa.
Il primo equivoco riguarda le densità di energia volumetrica e specifica. I valori di testa da 4 a 5 volte si riferiscono solo alla densità di energia specifica e a un numero limitato di prodotti chimici delle batterie agli ioni di litio, alcuni dei quali non sono ancora in uso commerciale. Fig. 2 confronta diversi catodi per celle di batterie agli ioni di litio, questi vanno da circa 100Wh/kg per la chimica Li-FePO4 più sicura a oltre 200Wh/kg per la variante nichel-cobalto-ossido di alluminio. Il diagramma della batteria al piombo è riportato di seguito:


Questi valori si applicano solo al livello della singola cella, non al pacco o alle condizioni di servizio. Fig. 3 mostra le densità di energia di diversi tipi di batterie a livello di cella e di sistema. Le densità di energia delle celle delle batterie agli ioni di litio sono praticamente dimezzate quando sono completamente installate con tutti i collegamenti, il raffreddamento, la sicurezza e l’attrezzatura di gestione della batteria.
Il vantaggio a livello delle cellule di 3 o 5 volte la densità di energia specifica si riduce a 2 o 3 volte. A seconda della chimica del catodo di litio, potremmo quasi essere alla ricerca della parità tra le batterie agli ioni di litio e le batterie al piombo per un sistema di batterie completamente installato in alcune applicazioni.
Anche l’altro fattore, quello della durata del ciclo, è fonte di confusione. Quanti cicli può fare una batteria agli ioni di litio prima che la capacità scenda sotto l’80% del suo valore nominale? Due, tremila? La tabella 1 fornisce un riassunto dei diversi materiali del catodo Li-ion per le prestazioni e la durata del ciclo.
Vantaggi della chimica delle batterie al piombo
Le batterie sono strani dispositivi. Nessuno li vuole, ma tutti ne hanno bisogno. Si comprano solo quando è necessario. Quante persone pianificano un viaggio al centro commerciale locale per guardare le vetrine e comprare delle batterie? Sono un acquisto di rancore e si comprano solo quando è assolutamente necessario. Un buon venditore può vendervi due paia di scarpe, due automobili e forse due case se avete i soldi, ma non può vendervi due batterie per automobili SLI. Quando compri una batteria, che sia una batteria solare per un pannello solare, una bici elettrica o un sistema di backup di UPS e inverter o una batteria di trazione per carrelli elevatori, non vorresti saperne di più?
Come funzionano le batterie al piombo, quali sono le differenze tra i tipi e i modelli, e le diverse chimiche? Possono essere costosi. In un’applicazione commerciale o domestica, qual è il ritorno economico, la durata e il costo di sostituzione di una batteria al piombo? Le dimensioni necessarie, lo spazio disponibile, l’efficienza energetica della batteria al piombo e il tempo di ricarica? E poi, ci sono i costi nascosti della sicurezza, dello smaltimento e dell’impronta di carbonio. Questo articolo confronta le batterie al piombo acido con le batterie agli ioni di litio e affronta molte delle idee sbagliate associate a entrambi questi prodotti chimici.
Quale batteria agli ioni di litio è la migliore
| Materiale catodico | Nome breve | Tensione nominale | Energia specifica Wh/kg (cella) | Durata del ciclo | Commenti |
|---|---|---|---|---|---|
|
Ossido di cobalto al litio (LiCoO2) |
LCO | 3.6 | 150-200 | 500-1000 | Dispositivi portatili - fuga termica in caso di sovraccarico |
| Ossido di litio e manganese (LiMn2O4) | LMO | 3.7 | 100-150 | 300-700 | Utensili elettrici, dispositivi medici - più sicuro di LCO |
| Ossido di litio nichel manganese cobalto (LiNiMnCO2) | NMC | 3.6/3.7 | 150-220 | 1000-2000 | E-bikes, EV, industriale - alta durata del ciclo |
| Litio ferro fosfato (LiFePO4) | LFP | 3.2 | 90-120 | 1000-2000 | EV, SLI, Leisure - la più sicura di tutte le batterie agli ioni di litio |
| Ossido di litio nichel cobalto alluminio (LiNiCoAlO2) | NCA | 3.6 | 200-260 | 500 | Industriale, propulsore EV (Tesla) TR a 150C, CL 500 |
| Titanato di litio (Li4Ti5O12) | LTO | 2.4 | 50-80 | UPS, Solar, EV powertrain (Honda, Mitsubishi). CL 3000-7000 - molto sicuro |
Come si può vedere, tutti rientrano nell’intervallo tra 800 e 2000 cicli. In confronto, una batteria al piombo ben progettata può facilmente raggiungere più di 1600 cicli all’80% di DOD. Quindi, come si aggiunge tutto questo quando si considera il costo di proprietà? Questo ci porta al prossimo punto che è il prezzo delle batterie al piombo. Quanto costa una batteria agli ioni di litio rispetto a una batteria al piombo? Costo dell’impianto di produzione di batterie agli ioni di litio? Naturalmente, la batteria agli ioni di litio è più costosa, ma quanto di più. Di nuovo, questo dipende dal livello considerato. I comunicati stampa ci diranno che i prezzi del Li-ion stanno scendendo e ora sono nell’ordine di 2-3 volte quelli del piombo acido.
Davvero? I prezzi medi di una recente ricerca su internet nel Regno Unito per ottenere i prezzi delle batterie per il tempo libero disponibili in commercio da 12V e 100 Ah sia per le batterie agli ioni di litio che per quelle al piombo:
batteria agli ioni di litio $960 o $800/kwh
Batteria al piombo $215 o $180/kwh
Ovviamente, la durata della batteria agli ioni di litio deve essere 4 volte quella dell’equivalente batteria al piombo per ottenere lo stesso valore. Come abbiamo visto, questo non è il caso.


In tutti i casi, la costruzione della batteria al piombo-acido è stata la più conveniente anche quando è stata montata una batteria al piombo-acido più grande per dare una migliore accettazione della carica e una maggiore durata del ciclo. In questo esempio, l’applicazione era una torre di telecomunicazione in India. Lo stesso principio vale per la maggior parte delle applicazioni e delle aree geografiche, soprattutto nei climi più freddi. L’altro malinteso è che il Li-ion è una tecnologia più pulita e meno inquinante del piombo-acido. Le emissioni dalla culla al cancello per diversi tipi di batterie sono riportate nelle figure. 5 e 6.
Questa figura mostra il confine delle operazioni per la fabbricazione delle batterie. Dall’estrazione e il trasporto delle materie prime fino a tutte le fasi di lavorazione fino al punto in cui le batterie sono pronte per la spedizione.
La tabella 2 è una situazione reale che confronta l’economia dell’utilizzo di una batteria agli ioni di litio e di una batteria al piombo che lavora su diversi periodi di vita.
| Voce di costo | Costi di gestione giornalieri USD | Costi di gestione giornalieri USD |
|---|---|---|
| 3 anni | Batteria al piombo | Batteria agli ioni di litio |
| Ammortamento | 8.30 | 16.90 |
| Diesel (consegnato) | 15.50 | 15.50 |
| Manutenzione | 2.46 | 2.46 |
| Elettricità | 1.47 | 1.47 |
| Ricarica della batteria | 0.65 | 0.50 |
| Totale giorno/mese | 28.38/851 | 36.83/1105 |
| 6 anni | ||
| Ammortamento | 5.86 | 8.46 |
| Diesel | 15.50 | 15.50 |
| Manutenzione | 2.46 | 2.46 |
| Elettricità | 1.47 | 1.47 |
| Ricarica della batteria | 0.54 | 0.50 |
| Totale giorno/mese | 25.83/775 | 28.39/852 |
Questi dati da Argonne National Laboratories, mostrano che il processo di produzione totale, compresa l’estrazione e il trasporto delle materie prime per le batterie agli ioni di litio sono più di 4 volte il valore dell’acido di piombo. Per quanto riguarda l’estrazione dei materiali, la fornitura di materiali catodici di base come il cobalto e il manganese e il litio non sono completamente certi. I processi di estrazione e di recupero esistono, ma il numero di miniere e di siti di produzione può limitare l’offerta se la domanda aumenta significativamente. La mappa geopolitica prevede anche l’incertezza per alcune fonti di questi materiali.
Le batterie agli ioni di litio sono riciclabili
La riciclabilità e la sicurezza di questi prodotti chimici sono fattori importanti. È noto che quasi tutti i componenti delle batterie al piombo vengono riciclati al 100%, mentre non esistono processi commerciali per il riciclaggio delle batterie agli ioni di litio. Questa situazione è comprensibile se si considera che i componenti più costosi di Li, Co, Mn ecc. sono solo una piccola frazione del totale della batteria agli ioni di litio. Per esempio, il litio è circa il 4% del peso totale della cella. A questo si aggiunge il fatto ovvio che il litio è altamente reattivo (la base della sua alta densità di energia), che comprensibilmente lo rende costoso da estrarre dalle scorie.
Il fattore aggiuntivo di complessità con molti materiali diversi nella sua costruzione rende il riciclaggio difficile, sia tecnicamente che economicamente. Il risultato? Semplicemente non c’è nessun incentivo commerciale per riciclare queste batterie. Per questo motivo, gli impianti di riciclaggio sono ancora in fase pilota e per lo più finanziati dal governo.
Attualmente, la stragrande maggioranza delle batterie agli ioni di litio rottamate sono stoccate in attesa di una svolta tecnologica o di una legislazione che ne imponga il riciclaggio. Se quest’ultima dovesse essere attuata, allora ci sarebbe un costo, in ultima analisi, per i consumatori. Questo aumenterebbe ulteriormente il prezzo della cella Li-ion rispetto ai tipi di batterie al piombo.
La batteria agli ioni di litio può esplodere
Infine, abbiamo la sicurezza. Nessuna applicazione di batterie al piombo acido a nostra conoscenza ha mai avuto un richiamo di sicurezza come sappiamo che è il caso della batteria Li-ion nei dispositivi elettronici portatili e anche nei veicoli elettrici. Fig. 7 mostra cosa è successo a una nuova Volvo ibrida nel Regno Unito solo un paio di settimane fa, al momento di scrivere questo articolo. In questo caso le sue batterie agli ioni di litio hanno preso fuoco durante la carica.
Incendi di batterie agli ioni di litio
Figura 7 Incendio causato da una batteria Li-ion in un veicolo elettrico ibrido Volvo: Aprile 2018-residenza nel Regno Unito


Questo video mostra un incendio molto recente causato da una batteria al litio. Probabilmente a causa di uno squilibrio nelle cellule e di un BMS improprio.
Anche se immagazzinate o trasportate, le batterie agli ioni di litio sono state la causa di incendi gravemente pericolosi. Anche se queste occasioni sono rare, devono essere riconosciute, e devono essere installati adeguati dispositivi di sicurezza e software di gestione della batteria. I vigili del fuoco di New York, per esempio, stanno ancora decidendo come affrontare gli incendi delle batterie agli ioni di litio. Questo suggerirebbe fortemente che le misure di sicurezza esistenti per le batterie agli ioni di litio in tutto il mondo devono essere riviste.
Ecco il punto di vista del dipartimento dei vigili del fuoco di New York:
Citazione dell’articolo di notizie: AWS utility drive 15 novembre 2016 “Il fuoco non è il problema più grande”, ha detto Rogers. I vigili del fuoco sono addestrati ad affrontare gli incendi, ma devono sapere con cosa hanno a che fare. Le batterie Li-ion possono rilasciare acidi tossici e vapori infiammabili. Alcuni di questi vapori sono consumati dal fuoco, ma se non lo sono, potrebbero infiammarsi o essere un problema per i pompieri. Il problema più grande è quello che succede “post-operatorio”, cioè dopo che il fuoco si è spento. Anche se una batteria è spenta potrebbe riaccendersi fino a 72 ore, ha detto Rogers. -Lt. Paul Rogers Fire Department of New York’s hazardous materials operations division”
Batteria agli ioni di litio o batteria al piombo?
La batteria agli ioni di litio ha sicuramente delle caratteristiche di prestazione migliori di quelle dell’acido di piombo. Tuttavia, questi vantaggi sono fortemente ridotti dall’hardware aggiuntivo associato ai requisiti di sicurezza e di gestione. Il risultato netto è che le batterie al piombo-acido hanno vantaggi distinti, in particolare quando si considerano le applicazioni che non sono limitate dal peso o dall’accettazione della carica. Il minor costo iniziale del costo dell’impianto di produzione di batterie al piombo;
il basso prezzo di acquisto e il basso costo di ammortamento dell’acido di piombo combinato con il suo basso impatto ambientale e la sicurezza intrinseca, forniscono i seguenti vantaggi:
- Prezzo d’acquisto più basso. Il prezzo è circa un quarto di un equivalente Li-ion. I costi operativi più bassi per dare un costo totale di proprietà inferiore nella maggior parte delle applicazioni.
- Riciclabilità. Quasi il 100% dei materiali delle batterie al piombo vengono riciclati. Il valore del rottame può fornire un’entrata aggiuntiva fino al 20% del costo del materiale della batteria. Le batterie al litio non hanno infrastrutture o processi commerciali per il riciclaggio
- Sicurezza. La chimica dell’acido di piombo è intrinsecamente più sicura di quella delle batterie agli ioni di litio
- Sostenibilità. Ci sono molte fonti di approvvigionamento ben consolidate per l’acido di piombo, in particolare dagli impianti di riciclaggio. Il litio e altri materiali catodici possono essere forniti da aree politicamente sensibili. Sia l’attuale capacità globale di estrazione dei materiali che la capacità di produzione non potrebbero sostenere un rapido aumento della produzione di batterie agli ioni di litio.
- Impronta di carbonio. La produzione di batterie al piombo ha un’impronta di carbonio dalla culla al cancello pari a un terzo di quella delle batterie agli ioni di litio.
Un quadro diverso da quello dipinto dalle aziende di batterie agli ioni di litio. Anche se non si può sostenere che l’acido di piombo ha uno svantaggio nella densità di energia, il fatto è che la batteria al piombo-acido è ancora una tecnologia altamente sicura, competitiva e la migliore scelta di batteria in molte applicazioni.
Cos'è la batteria agli ioni di litio
Materiali catodici e anodici: Anche se le celle nichel-metallo idruro (Ni-MH) sono state favorite inizialmente negli anni ’90, il primo prodotto commerciale al mondo di batterie ricaricabili agli ioni di litio è stato rilasciato nel 1991 da Sony Corporation. Oltre all’alto contenuto di energia, sia per massa che per volume, questa batteria offriva anche eccellenti caratteristiche a bassa temperatura, caratteristiche di carico e caratteristiche di ciclo. Come risultato, ha rapidamente catturato il mercato ed è diventato una fonte indispensabile di energia per apparecchiature audio e video, personal computer, telefoni portatili e altre apparecchiature portatili.
La tecnologia avanzata delle batterie di oggi è iniziata con la scoperta dell’alta conduttività ionica della fase solida NaAl11O17, chiamata sodio β-allumina, da Kummer e collaboratori presso il laboratorio Ford Motor Co. [1. Olof Ramsrtomström, sul premio Nobel per la chimica, Contesto scientifico del Premio Nobel per la Chimica 2019; 2. Y.F.Y. Yao e J.T. Kummer, J. Inorg. Nucl. Chimica. 29, 2453 (1967)].
Questo ha portato alla realizzazione che il trasporto ionico nei solidi può effettivamente essere molto veloce, e che potrebbe portare a una varietà di nuove tecnologie. Poco dopo, i ricercatori della Ford dimostrarono che si può usare un elettrolita solido altamente conduttivo per produrre un tipo completamente nuovo di batteria, usando sodio fuso all’elettrodo negativo e una soluzione fusa di sodio in zolfo come elettrodo positivo, con l’elettrolita solido conduttivo di sodio nel mezzo [N. Weber and J.T. Kummer, Proc. Annual Power Sources Conf. 21, 37 (1967)].
Come ci si poteva aspettare, fu presto presa in considerazione la possibilità di sistemi analoghi al litio, perché fu riconosciuto che una cella al litio altrimenti equivalente dovrebbe produrre tensioni più alte di una cella al sodio. Inoltre, il litio ha un peso inferiore al sodio, un altro vantaggio.
Il litio elementare non poteva essere usato, a causa del suo basso punto di fusione. Invece, sono state studiate le leghe solide di litio, principalmente i sistemi Li/Si e Li/Al [R.A. Huggins, J. Power Sources 81-82, 13 (1999)].
Un certo numero di materiali sono stati studiati a quel tempo come reattori dell’elettrodo positivo, con la maggior parte dell’attenzione data all’uso di FeS o FeS2. Alla reazione con il litio, questi materiali subiscono reazioni di ricostituzione, con la scomparsa delle fasi iniziali e la formazione di nuove fasi [D.R. Vissers, Z. Tomczuk e R.K. Steunenberg, J. Electrochem. Soc. 121, 665 (1974)].
Quando è stata inventata la batteria agli ioni di litio?
IlProf. Whittingham ha esplorato l’intercalazione elettrochimica in tali materiali e nel 1973 ha proposto tali materiali come elettrodi nelle batterie. Questo lavoro ha portato a una batteria funzionante e ricaricabile nel 1976. La cella riuscita era composta da litio metallico come anodo e solfuro di titanio (TiS2) come catodo, con esafluorofosfato di litio(LiPF6) come elettrolita in carbonato di propilene (PC) come solvente. Questi studi promettenti hanno ispirato Whittingham ad esplorare l’intercalazione elettrochimica in tali materiali come elettrodi nelle batterie. Una batteria ricaricabile funzionante è stata successivamente dimostrata nel 1976
[(a)Whittingham, M. S. Electrointercalation in Transition-Metal Disulphides. J. Chem. Soc., Chem. Commun. 1974, 328-329.] (con Exxon Research and Engineering Company).
(b)Whittingham, M. S. Batterie à Base de Chalcogénures. Brevetto belga n. 819672, 1975.
(c)Whittingham, M. S. Accumulo di energia elettrica e chimica di intercalazione. Scienza 1976, 192 (4244), 1126-1127.
Ma il successo fu di breve durata. Su cicli ripetuti, il litio metallico ha formato dei dendriti sulla superficie metallica durante il ciclaggio, provocando dei cortocircuiti.
Questo problema ha dato impulso a una nuova ricerca di soluzioni alternative e fu proposta una configurazione di “cella a trasferimento ionico” (chiamata anche “sedia a dondolo”), dove entrambi gli elettrodi possono ospitare ioni.
Se un materiale elettrodico positivo contiene inizialmente litio e una parte o tutto il litio viene rimosso durante la prima carica, la cella sviluppa un potenziale. Pertanto, è possibile avere materiali elettrodici positivi che reagiscono con il litio a potenziali superiori a circa 3V, se già contengono litio, e questo litio può essere estratto elettrochimicamente.
Chi ha inventato la batteria agli ioni di litio?
Questo approccio, che prevede l’uso di materiali in cui il litio è già presente, è stato dimostrato per la prima volta dal Prof. Goodenough. I primi esempi di materiali che contengono inizialmente litio, e che eliminano elettrochimicamente il litio da essi, sono stati il lavoro su Li1-xCoO2 nel 1980.
[K. Mizushima, P.C. Jones, P.J. Wiseman e J.B. Goodenough, Mater. Res. Bull. 15, 783 (1980)] e Li1-xNiO2
[J.B. Goodenough, K. Mizushima e T. Takada, Jpn. J. Appl. Phys. 19 (Suppl. 19-3), 305 (1980)]
Parallelamente allo sviluppo dell’anodo, sono stati ricercati anche materiali catodici migliori per acquisire una maggiore emf della cella in combinazione con anodi di potenziale più elevato del litio metallico. Una svolta è arrivata nel 1979/1980 quando John B. Goodenough e i suoi collaboratori di Oxford
University, Regno Unito, ha scoperto che LixCoO2, un altro calcogenuro metallico intercalato di tipo MX2, potrebbe servire come materiale catodico.
[Goodenough, J. B.; Mizushima, K. Fast Ion Conductors. Brevetto USA n. 4.357.215, 1982].
[Mizushima, K.; Jones, P. C.; Wiseman, P. J.; Goodenough, J. B. LixCoO2 (0<x<-1): Un nuovo
Materiale catodico per batterie ad alta densità energetica. Mater. Res. Toro. 1980, 15 (6), 783-789].
La struttura del materiale era analoga a quella del LixTiS2 con lacune di van der Waals tra il biossido di cobalto (CoO2) strati in cui gli ioni di litio potrebbero essere legati senza molta espansione del reticolo. Goodenough ha ragionato che quando X in MX2 è un piccolo elemento elettronegativo, un processo di assorbimento del catione risultante sarebbe associato a un grande cambiamento di energia libera negativa e a una tensione di cella elevata (ΔG = -nFE). Con una X di ossigeno, la situazione è stata ritenuta particolarmente promettente, dato anche che gli ioni di litio sono stati proposti per essere sufficientemente mobili in matrici di ossigeno vicine.
Il ragionamento si è rivelato corretto, e il materiale CoO2 ha mostrato un potenziale molto alto di ~4 a 5 V rispetto a Li+/Li. Gli studi elettrochimici sono stati effettuati in questo caso con un elettrolita composto da tetrafluoroborato di litio (LiBF4) in carbonato di propilene.
Questa scoperta ha permesso l’uso di materiali anodici con potenziali più alti del litio metallico, favorendo la ricerca di materiali carbonacei adatti. Considerando la difficoltà di risolvere il problema dell’intercalazione elettrochimica della grafite, sono state invece studiate altre opzioni.
Dove è stata inventata la batteria agli ioni di litio?
Una svolta è arrivata nel 1985 quando un gruppo giapponese guidato da Akira Yoshino (di Asahi Kasei Corporation) ha scoperto le fibre di carbonio coltivate in fase di vapore (VGCF) e successivamente il coke di petrolio trattato termicamente. Quest’ultimo materiale era noto per contenere una miscela di domini cristallini (grafitici) e non cristallini, e i ricercatori hanno potuto identificare qualità particolarmente stabili, ma performanti, con specifici gradi di cristallinità.
[Akira Yoshino, The Birth of Li-Ion Battery, Angewandte Essays, Angew., Chem. Int. Ed., 2012, 51, 5798-5800]
Con questi materiali anodici efficaci, Yoshino ha sviluppato una batteria agli ioni di litio efficiente e funzionante basata sulla configurazione della cella a trasferimento ionico. Il materiale carbonioso identificato è stato quindi utilizzato come anodo e il materiale LixCoO2 di Goodenough (tipicamente contenente piccole quantità di stagno) è stato utilizzato come catodo. Sono stati utilizzati strati separatori composti da polietilene o polipropilene e l’elettrolita era composto da perclorato di litio (LiClO4) in carbonato di propilene (PC).
Yoshino ha anche dimostrato la sicurezza di questa batteria nel 1986 facendo cadere un peso sulla batteria. Non si sono verificati incendi o esplosioni, mentre le batterie con anodo di litio metallico hanno reagito violentemente.

Figura 8. I primi test di sicurezza di Yoshino con la sua batteria Li-ion nel 1986.
A) Il momento in cui un grumo di ferro si scontra con la batteria
B) Prototipo di batteria Li-ion dopo la collisione
C) Batteria metallica ad anodo di Li dopo la collisione
[Credito: Akira Yoshino, The Birth of Li-Ion Battery, Angewandte Essays, Angew. Int. Ed., 2012, 51, 5798-5800 ]
Queste scoperte e sviluppi hanno infine portato al rilascio di una batteria al litio commerciale
nel 1991. Con ulteriori sviluppi, la batteria Li-ion è stata commercializzata da Sony nel 1991 e da una joint venture di Asahi Kasei e Toshiba nel 1992.
[Nishi, Y., Lo sviluppo delle batterie secondarie agli ioni di litio. Chem. Rec. 2001, 1, 406-413]
La batteria era basata su un materiale anodico a base di coke di petrolio, LixCoO2 come catodo, e un elettrolita senza acqua composto da esafluorofosfato di litio (LiPF6) in carbonato di propilene (PC). La tensione di carica era alta (fino a 4,1 V), con un’energia specifica registrata di ~80 Wh/kg e una densità energetica di ~200 Wh/litro.
Rispetto ad altre batterie che erano sul mercato all’epoca, la batteria al litio divenne rapidamente molto competitiva ed essenzialmente aprì la strada alla prossima rivoluzione mobile.
All’incirca nello stesso periodo, si scoprì che la grafite poteva effettivamente essere usata in combinazione con una composizione elettrolitica adatta. [Fong R, Sacken U von, Dahn J. R., Studies of Lithium Intercalation into Carbons Using Nonaqueous Electrochemical Cells. J. Electrochem. Soc. 1990, 137 (7), 2009-2013]
Utilizzando solventi contenenti carbonato di etilene, finora generalmente trascurato a causa del suo più alto punto di fusione, si è formata un’interfase elettrolitica solida (SEI) sulla superficie dell’elettrodo di grafite durante il ciclo di carica/scarica, proteggendo così il materiale di carbonio dall’esfoliazione e dall’ulteriore decomposizione. [Peled, E. The Electrochemical Behaviour of Alkali and Alkaline Earth Metals in Nonaqueous Battery Systems, The Solid Electrolyte Interphase Model. J. Elettrochimica. Soc. 1979, 126 (12), 2047-2051.
Questa scoperta è stata rapidamente adottata dalla comunità delle batterie, ed è stata sviluppata una batteria agli ioni di litio di nuova generazione basata sulla grafite come materiale anodico. Con questo materiale anodico, subito dopo sono state prodotte batterie con tensioni di carica di 4,2 V, con una densità energetica di ~400 Wh/litro.
Lo sviluppo della batteria agli ioni di litio non si è fermato con queste importanti scoperte, ma da allora sono stati segnalati molti miglioramenti e alternative. Per esempio, nuovi materiali catodici sono stati continuamente identificati per l’uso in specifiche applicazioni di batterie, e due di questi materiali sono nati dal gruppo di Goodenough: il materiale spinello Li1-xMn2O4 e il materiale olivina LixFePO4 (LFP).
[Padhi, A. K.; Nanjundaswami, K. S.; Goodenough, J. B. Phospho-Olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries. J. Electrochem. Soc. 1997, 144, 1188-1194.
Thackeray, M. M.; David, W. I. F.; Bruce, P. G.; Goodenough, J. B. Lithium Insertion into Manganese Spinels. Mater. Res. Bull. 1983, 18, 461-472].
Quest’ultimo materiale è limitato da un potenziale un po’ più basso contro Li+/Li rispetto a LixCoO2, ma ha un’alta stabilità e può essere usato a tassi di carica elevati. Sono stati scoperti anche molti altri materiali elettrodici e sistemi elettrolitici, che hanno portato a materiali di stoccaggio dell’energia sempre migliori a beneficio della società.
Che tipo di batteria si usa nei veicoli elettrici?
Al giorno d’oggi, la maggior parte dei veicoli elettrici utilizza batterie Li-ion. In precedenza, venivano utilizzate batterie Ni-MH e piombo-acido, ma il loro uso è lentamente diminuito a causa dell’avvento delle batterie Li-ion, che possiedono una maggiore energia specifica e valori di densità energetica più elevati. L’energia specifica delle batterie al piombo è di circa 40-50 Wh/kg mentre la batteria Li-ion ha circa 150 Wh/kg. Il valore di densità energetica per le batterie al piombo è di 80-100 Wh/litro, mentre la batteria agli ioni di litio ha più di 250 Wh/litro.
Le celle cilindriche con catodi di nichel-cobalto-alluminio (NCA) e anodi compositi di silicio/grafite, come quelli usati nelle ultime batterie Tesla (2019-2020), hanno raggiunto circa 270 Wh/kg e 650 Wh/litro. Una nuova tecnologia chiamata Licerion di Sion Power dichiara 500 Wh/kg di energia specifica e 1000 Wh/L di densità energetica e >450 cicli in celle di sviluppo da 0,4 Ah.
Per le piccole batterie, si parla in termini di Wh. Per i sistemi di maggiore capacità, si usa l’unità kWh. Il valore Wh diviso per 103 darà il kWh.
Così 850 Wh = 850/1000 = 0,850 kWh.
Le celle usate nelle batterie EV di oggi possono raggiungere un’energia specifica nominale di 140 -170 Wh/kg. L’energia specifica del pacco batterie risultante è tipicamente inferiore del 30-40 per cento, o 80-120 Wh/kg. La riduzione è dovuta a diversi cavi di collegamento in serie e in parallelo, al BMS e al sistema di gestione termica (raffreddamento o riscaldamento). Nel 2019, la percentuale del pacchetto di componenti non cellulari è scesa a circa il 28%.
Fino ad ora, le celle venivano prima messe in moduli e poi in pacchi. Entrambi Contemporanea Amperex Technology Co. Limited, Cina (CATL) e Tesla hanno deciso che vogliono sbarazzarsi dei moduli e mettere le celle in pacchi direttamente. CATL lo ha già fatto e lo chiama
tecnologia cell-to-pack
. Mentre le informazioni su questo sono scarse, l’azienda sostiene che questo può aumentare l’energia specifica del 10-15% e migliorare l’utilizzo del volume del 15-20%. In totale, si dice che può ridurre le parti necessarie per i pacchi batteria del 40%. [https ://cleantechnica.com/2020/02/18/how-catl-lithium-iron-phosphate-batteries-could-be-leading-to-100-kwh-tesla-model-3/]
Designazione della batteria al litio
La Commissione Elettrotecnica Internazionale (IEC) e la Indian Standards Institution hanno stabilito una designazione comune per descrivere la chimica e le dimensioni delle celle agli ioni di litio.
[Celle e batterie secondarie al litio per applicazioni portatili, Commissione Elettrotecnica Internazionale, IEC 61960-1 e IEC 61960-2 e IS 16047: 2012].
Le lettere designano la chimica e il fattore di forma, mentre i numeri specificano le dimensioni fisiche della cella. La prima lettera descrive la chimica generale, la seconda lettera designa la chimica specifica del catodo e la terza lettera designa la forma.
Prima lettera: I – chimica degli ioni di litio
Seconda lettera: C – cobalto, F – ferro, Fp – fosfato di ferro, N – nichel, M – manganese, Mp – fosfato di manganese, T – titanio, V -vanadio e x – altri.
Terza lettera: R- cilindrica, P-prismatica
I primi due numeri che seguono designano il diametro in mm e gli ultimi tre a designare l’altezza in decimi di mm. Così una cella designata ICR19/66 è una cella agli ioni di litio con un catodo di cobalto che ha un diametro che è > 18 mm e ≤ 19 mm e un’altezza massima complessiva che è > 65 mm e ≤ 66 mm.
Per le celle prismatiche le lettere iniziali hanno lo stesso significato ma i primi due numeri designano la larghezza in mm, i due numeri successivi sono l’altezza in mm e gli ultimi due numeri sono la lunghezza in mm. Così, una designazione di cella IMP9/35/150 descrive una cella prismatica agli ioni di litio con una cella a catodo di manganese il cui spessore massimo è > 8 mm e ≤ 9 mm e una larghezza massima che è > 34 mm e ≤ 35 mm e un’altezza totale massima che è > 149 mm e ≤ 150 mm.
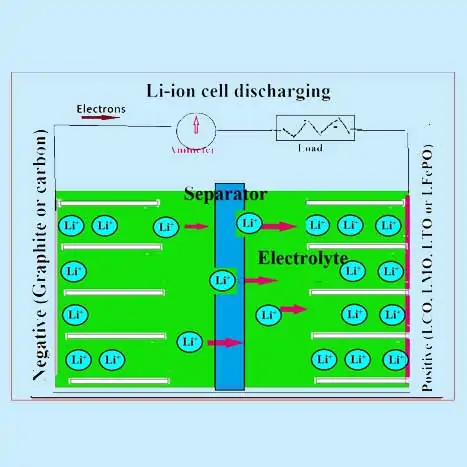
Come funziona una batteria agli ioni di litio?
come sono fatte le batterie agli ioni di litio
Il litio metallico con numero atomico 3, densità di 0,534 g/cc, con un potenziale di riduzione standard molto basso (coppia Li+/Li -3,05 V contro SHE) e una capacità specifica teorica di 3860 Ah/kg (2061 mAh/cc) è il più leggero, il più alto voltaggio e la più grande densità energetica di tutti i metalli. (Confronta con il piombo di numero atomico 82, densità 11,29 g/cc, capacità specifica teorica di 257,8 Ah/kg e potenziale di riduzione standard di -0,35V contro SHE).
Batteria agli ioni di litio - Materiali attivi
I materiali attivi dell’elettrodo positivo sono uno qualsiasi degli ossidi misti come LiCoO2 o LiMnO2 o LiFePO4. L’elettrodo negativo è principalmente composto da grafite e carbonio amorfo. Viene utilizzato un elettrolita organico (contenente un sale conduttore di litio dissociato come il LIPF6). Si utilizza un separatore in polipropilene (PP) o polietilene (PE) o misto. Gli ioni di litio migrano avanti e indietro tra gli elettrodi delle batterie agli ioni di litio durante la carica e la scarica e sono intercalati nei materiali attivi come descritto di seguito:

Figura 9. Una vista esplosa di una cella agli ioni di litio
Credito: Zhang Z., Ramadass P. (2012) Sistemi di batterie agli ioni di litio e tecnologia. In: Meyers R.A. (eds) Encyclopaedia of Sustainability Science and Technology. Springer, New York, NY, pp 6124. http s://doi.org/10.1007/978-1-4419-0851-3_663
Come si carica la batteria agli ioni di litio
Durante un processo di scarica in una cella a ioni di litio (LIB) gli ioni di litio dall’anodo sono de-intercalati (o estratti) nell’elettrolita e questi ioni di litio dall’elettrolita sono intercalati nel materiale catodico. Questo movimento degli ioni dall’anodo al catodo è accompagnato dal rilascio di elettroni che scorre nel circuito esterno. Il processo inverso si verifica durante il processo di carica dove gli ioni di litio si spostano dal catodo e si intercalano nell’anodo attraverso l’elettrolita. Le LIB commerciali usano tipicamente ossidi di metalli di transizione come LiCoO2, LiMn2O4 e LiFePO4 come materiale catodico, che è rivestito su un collettore di corrente in alluminio.
Dal dieci al venti per cento di carbonio conduttivo e il 5-10 di leganti polimerici come il difluoruro di polivinilidene (PVDF) e il politetrafluoroetilene (PTFE) vengono aggiunti insieme al materiale attivo per migliorare la conduttività elettronica e ottenere una migliore adesione del materiale elettrodico, rispettivamente. Il materiale anodico è rivestito su un collettore di corrente in rame con carbonio conduttore e PVDF se necessario.
I due elettrodi sono separati da un separatore poroso (film di polietilene o polipropilene di spessore 10-20 µm) imbevuto di una soluzione elettrolitica (LiPF6 in un solvente organico). Sia il separatore che la soluzione elettrolitica dovrebbero avere una migliore conducibilità ionica. La cella è di solito fabbricata in un involucro metallico a forma di jellyroll con un separatore immerso nell’elettrolita tra i due elettrodi. Uno schema di una LIB è mostrato nelle figure, dove sono mostrati i tipici processi di carica e scarica.
Le batterie ricaricabili agli ioni di litio (Li-ion) impiegano un inserimento/estrazione reversibile di ioni di litio (Li+) (specie ospite) in o da una matrice ospite (materiali attivi dell’elettrodo positivo e negativo) chiamati composti di inserimento del litio quando si verificano i processi di scarica e carica. Le batterie agli ioni di litio sono state chiamate batterie a sedia a dondolo perché gli ioni di litio “dondolano” avanti e indietro tra gli elettrodi positivi e negativi quando la cella viene caricata e scaricata.
Il materiale attivo positivo è tipicamente un ossido di metallo con una struttura a strati, come l’ossido di cobalto di litio (LiCoO2), o un materiale con una struttura a tunnel, come l’ossido di manganese di litio (LiMn2O4), per lo più su un collettore di corrente in alluminio. Il materiale attivo negativo è tipicamente un carbonio grafitico, anch’esso un materiale stratificato, per lo più su un collettore di corrente in rame. Nel processo di carica-scarica, gli ioni di litio sono inseriti o estratti dallo spazio interstiziale tra gli strati atomici dei materiali attivi.
Nelle celle al litio si usano elettroliti non acquosi o elettroliti organici.
I separatori per le batterie agli ioni di litio sono film poliolefinici microporosi in polietilene (PE) e polipropilene (PP).

Reazioni elettrochimiche della cella nella batteria agli ioni di litio
In una tipica cella agli ioni di litio, si verificano le seguenti reazioni generiche.
Reazione dell’elettrodo positivo:
LiMO2⇔ Li1-xMO2 + x Li+ + x e-
Reazione dell’elettrodo negativo:
C + y Li+ + ye- ⇔ LiyC
Reazione cellulare totale:
LiMO2 + x/y C ⇔ x/y LiyC + Li1-xMO2
M = metalli come Co, Mn, Ni, Ti, ecc.
Normalmente x è circa 0,5 e y è circa 0,16, quindi x/y è circa 3. [Jeff Dahn e Grant M. Ehrlich. “Batterie agli ioni di litio”, Linden’s Handbook of Batteries,4a edizione, Thomas B. Reddy (Ed.), McGraw
Elettrolita e interfase solido-elettrolita (SEI)
Come menzionato in precedenza, nelle celle al litio vengono utilizzati elettroliti non acquosi o elettroliti organici. Le Li-cell funzionano a tensioni relativamente più alte, fino a 4,2 V per cella. Anche se i sali di litio ingombranti come l’esafluorofosfato di litio (LiPF6), l’esafluoro arsenato di litio (LiAsF6), il tetrafluoroborato di litio (LiBF4), il perclorato di litio (LiClO4), il trifluorometansolfonato di litio (LiCF3SO3), il difluoro(ossalato) borato di litio (LIODFB) ecc. , sono gli elettroliti veri e propri (sali elettrolitici sostenitori), richiedono solventi adatti stabili a tale tensione superiore. La maggior parte di tali solventi hanno costanti dielettriche elevate, facilitando la dissociazione ionica più facile e l’esistenza di ioni di litio altamente concentrati. Tali solventi servono anche come guaine di solvatazione per l’esistenza stabile degli ioni Li, diminuendo così l’influenza dei contro anioni.
Lo svantaggio di avere costanti dielettriche elevate è che hanno valori di viscosità più alti che si traducono in una mobilità compromessa degli ioni. Per superare la minore conducibilità ionica, i solventi a bassa viscosità sono solitamente mescolati con solventi ad alta viscosità. Ma, poiché i solventi a bassa viscosità hanno una dissociazione ionica inferiore, diventa imperativo trovare un rapporto di miscelazione ottimale in modo che la miscela abbia sia una buona conducibilità ionica che una buona mobilità. Come solventi non acquosi, le miscele di carbonato di etilene (EC) con carbonati alchilici lineari meno viscosi come il dimetil carbonato (DMC), il dietil carbonato (DEC) e l’etil metil carbonato (EMC) sono usati nelle LIB disponibili in commercio.
I solventi aprotici sono eteri, esteri e carbonati alchilici: Sono etere dietilico (DEE), tetraidrofurano (THF), diossolano, carbonato di etilene (EC), carbonato di propilene (PC), dimetil carbonato (DMC), dietil carbonato (DEC), etil metil carbonato (EMC), formiato di metile, γ-butirrolattone (BL), acetato di metile, acetonitrile (AN), dimetilsolfossido (DMSO), dimetilformammide (DMF), cloruro di metile, nitrometano ecc.)
Gli elettroliti liquidi sono soluzioni di un sale di litio in uno o più solventi organici, tipicamente carbonati
Il carbonato di propilene (PC) non può essere usato come elettrolita se la grafite deve essere usata come anodo, poiché il primo si decompone sulla superficie della grafite; il PC usato da solo, senza EC o piccole aggiunte di LiBOB) Li bisoxalato borato), può causare la degradazione degli elettrodi di grafite poiché si co-intercalano con il litio, con conseguente esfoliazione.
L’elettrolita è invariante (lo stesso numero di ioni che entrano ed escono dall’elettrolita durante la carica e
scarico). Il sale elettrolitico è solitamente disciolto in solventi organici carbonati. Ogni produttore ha una diversa combinazione di solventi con il carbonato di etilene (EC) che è un denominatore comune per la maggior parte dei
La formazione dello strato intermedio solido-elettrolitico (SEI) è un’altra importante funzione svolta dagli elettroliti. Quando un metallo alcalino è immerso in un elettrolita della batteria, o quando un potenziale negativo è applicato a un carbonio o a un elettrodo inerte immerso nell’elettrolita, inizia a formarsi un SEI.
Lo strato SEI che si forma istantaneamente al contatto del metallo con la soluzione, consiste in prodotti di riduzione insolubili e parzialmente solubili dei componenti dell’elettrolita. SEI è il fattore chiave che determina la sicurezza, la capacità di potenza, la morfologia dei depositi di litio, la durata di conservazione e la durata del ciclo della batteria. Anche una buona adesione all’anodo è importante.
Come sottolineato sopra, le batterie alcaline o alcalino-terrose primarie o secondarie pratiche possono essere costruite solo se la dissoluzione o la corrosione dell’anodo può essere fermata. Pertanto, l’elettrolita deve essere progettato per contenere almeno un precursore SEI che reagisce rapidamente con il litio (o con l’anodo del metallo alcalino) per formare un’interfase solida-elettrolita insolubile. I prodotti della riduzione degli anioni salini sono tipicamente composti inorganici come LiF, LiCl e Li2O, che precipitano sulla superficie dell’elettrodo. La riduzione del solvente è seguita dalla formazione sia di componenti SEI insolubili come Li2CO3 che di semi-carbonati e polimeri parzialmente solubili.
Nel caso dell’elettrodo di carbonio, la tensione alla quale si forma il SEI dipende dal tipo di carbonio, dalle proprietà catalitiche della sua superficie (contenuto di ceneri, tipo di piano cristallografico, rapporto piano basale-bordo), dalla temperatura, dalla concentrazione e dai tipi di solventi, sali e impurità, e dalla densità di corrente. Alla prima carica di una batteria agli ioni di litio, c’è una perdita di capacità chiamata “perdita di capacità irreversibile” (QIR) principalmente necessaria per la formazione del SEI.
Oltre alla formazione del SEI, il QIR può essere causato dalla perdita di capacità associata alla formazione di prodotti di riduzione solubili (QSP).
Un SEI senza contaminazione è essenziale per la lunga durata del ciclo della batteria. Diventa ancora più importante durante i cicli ad alte velocità e ad una maggiore profondità di scarica.
I SEI nelle soluzioni di esafluorofosfato di litio (LiPF6) e di esafluoroarsenato di litio (LiAsF6) hanno una maggiore resistività rispetto alle soluzioni di altri sali. Ciò è dovuto ai cambiamenti di resistività che contribuiscono alla resistenza controllata dalle specie che portano all’alta impedenza interfacciale dell’anodo di litio negli elettroliti LiPF6 e LiAsF6. Inoltre, Li2CO3 è dichiarato essere uno dei migliori agenti passivanti per il miglioramento dell’efficienza del litio-ciclo [J Electrochem Soc.,164 (7) A1703-A1719 (2017)].
Separatori per batterie agli ioni di litio
I separatori per le batterie agli ioni di litio sono film poliolefinici microporosi e sono generalmente polietilene (PE) e polipropilene (PP) trafilati in modo monoassiale, PE trafilato in modo biassiale o PP/PE/PP trafilato in modo multiassiale.
Materie prime per i materiali attivi nella batteria agli ioni di litio
Le batterie agli ioni di litio utilizzano diversi materiali catodici. L’anodo è invariabilmente a base di carbonio, tranne alcuni come gli anodi di ossido di titanio-niobio, lega Li-Si ecc. La tabella e la figura seguenti danno alcune idee sulle diverse chimiche impiegate in queste batterie.

Figura 12. Un riassunto di alcune opzioni di chimica degli elettrodi presenti e future per le batterie agli ioni di litio. La capacità proposta del Li(Si) è il 50% della capacità teorica del materiale, simile al caso trovato per alcuni dei materiali elettrodici positivi
[Credito: Yu Miao, Patrick Hynan, Annette von Jouanne e Alexandre Yokochi, Energies 2019, 12, 1074; doi:10.3390/en12061074]
Tabella 1.
Caratteristiche delle celle agli ioni di litio con diversi materiali catodici
| Materiale catodico | Li-Ni-Co-Al (NCA) | Li-Ni-Mn-Co (NMC) | Li-MnO2 (LMO) | Fosfato di Li-Iron (LFP) | Titanato di Li (LTO) | Ossido di cobalto Li (LCO) |
|---|---|---|---|---|---|---|
| Tensione nominale di una cella (V) | 3.6 | 3.65 (2.7-4.2) | 3.8 | 3.25 (2-3.6) | 3.2 | 3.6 |
| Energia specifica teorica (Wh/kg) | 279 | 256 | 148 | 128 (373) | 293 (175) | 274 (370) (x=0.5) |
| Capacità specifica per i catodi (Ah/Kg) Potenziale vs Li/Li+ (V) | 180-200 (3.8) | 200 | 148 (4.1) | 150-170 (3.45) | 175 | 274 (3.9) (x=0.5) |
| Energia specifica per i catodi (Wh/Kg) | 680-760 | 610-680 | 410-492 548 | 518-587 544 | -- | 546 |
| Sicurezza | sicuro | Moderato | Sicuro | Alto | Molto buono | Moderato |
Materiali catodici in batteria agli ioni di litio
I materiali catodici devono soddisfare diversi requisiti da cui dipende la scelta del materiale dell’elettrodo positivo.
- Per fornire un’alta capacità, questi materiali devono incorporare una grande quantità di litio come fatto.
- Inoltre, i materiali devono intercalare reversibilmente con pochi cambiamenti strutturali per permettere una lunga durata del ciclo, un’alta efficienza in ampere ora e un’alta efficienza energetica.
- Per ottenere un’alta tensione di cella e un’alta densità di energia, la reazione di scambio del litio deve avvenire ad un alto potenziale rispetto al litio.
- Per facilitare i processi di carica e scarica ad alta velocità, la conduttività elettronica e la mobilità degli ioni di litio nel materiale devono essere elevate.
- Il materiale dell’elettrodo positivo non deve dissolversi nell’elettrolita e deve essere disponibile a costi accessibili. Per minimizzare i costi, è preferibile la preparazione da materiali poco costosi in un processo a basso costo
Il LiFePO4 è un’eccezione a questa regola. Nel LiFePO4, un adeguato trasporto di ioni di litio si ottiene con l’uso di particelle di elettrodi di dimensioni nanometriche. [Jeff Dahn e Grant M. Ehrlich. “Batterie agli ioni di litio”, Linden’s Handbook of Batteries,4a edizione, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26.6, 2011]
I materiali attivi positivi (PAM) nelle celle agli ioni di litio variano a seconda del produttore. I materiali catodici possono essere classificati in tre grandi categorie [Arumugam Manthiram, Nature Communications (2020) 11:1550] . Essi sono:
Ossidi stratificati - materiali catodici nelle batterie agli ioni di litio
Diversi ossidi del tipo generale LiMO2 (dove M =vanadio, cromo, cobalto e nichel) cristallizzano in una struttura stratificata in cui lo ione Li+ eM3+ occupano le corsie alternate della struttura salina per dare una sequenza di strati O-Li-O-M-O.
Nel catodo di ossido stratificato LiCoO2, le grandi differenze di carica e dimensione tra gli ioni Li+ e gli ioni trivalenti Co3+ portano a un buon ordinamento dei cationi, che è fondamentale per sostenere la diffusione bidimensionale veloce degli ioni di litio e la conduttività nel piano del litio.
I materiali catodici richiedono livelli di purezza estremamente elevati e devono essere quasi completamente privi di impurità metalliche indesiderate – in particolare ferro, vanadio e zolfo.

Figura 13. Schema semplificato di una struttura stratificata in cui c’è un’occupazione alternata del
strati di cationi tra gli strati di ioni di ossido ravvicinati.
[Credito: Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.168]
La buona stabilità strutturale insieme all’alta conducibilità elettrica e agli ioni di litio offre caratteristiche di carica e scarica veloci con una buona reversibilità. Con queste caratteristiche, LiCoO2 rimane come uno dei migliori catodi fino ad oggi con un’alta tensione operativa di ~4 V. Il catodo LiCoO2 ha risolto
due grandi sfide associate ai catodi di solfuro perseguiti negli anni ’70. Ha permesso non solo un aumento sostanziale della tensione di funzionamento da <2,5 V a ~4 V, ma anche l’assemblaggio di una cella senza la necessità di utilizzare un anodo metallico al litio.
Ossidi di spinello - materiali catodici nelle batterie agli ioni di litio
La seconda classe di catodi è lo spinello LiMn2O4. (La formula generale è AB2O4). Anche se questa struttura è generalmente raffigurata in coordinate cubiche, ha anche strati paralleli di ioni ossido su piani (111), e ci sono sia siti coordinati ottaedricamente che siti coordinati tetraedricamente tra i piani degli ioni ossido. Il numero di siti ottaedrici è uguale al numero di ioni ossido, ma ci sono il doppio dei siti tetraedrici. La stabilità strutturale tridimensionale e l’alta conducibilità elettrica e degli ioni di litio offrono caratteristiche di carica-scarica ancora più veloci per Li1-xMn2O4 con buona reversibilità rispetto a LiCoO2.
Un vantaggio importante nel passare da LiCoO2 a LiMn2O4 è la riduzione significativa del costo, dato che il manganese è due ordini di grandezza inferiore al Co. Tuttavia, un problema critico con LiMn2O4 è la dissoluzione del manganese dal reticolo nell’elettrolita in presenza di tracce (livelli ppm) di ioni H+ (acidità) nell’elettrolita a causa delle note sproporzioni di Mn3+ a Mn4+ e Mn2+ in acido.

Figura 14 . Schema della struttura dello spinello in cui i cationi sono distribuiti tra i piani (111) ravvicinati degli ioni di ossido tra siti tetraedrici e ottaedrici [Credito: Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.17].
Il materiale catodico ad alta tensione litio-nichel-manganese ossido (LNMO) sembra promettente nelle batterie di prossima generazione. Ma lo scoglio è la mancanza di un elettrolita che possa gestire le sollecitazioni di una batteria basata su LNMO. Le celle della batteria basate sul catodo LNMO forniscono risultati alla pari con altre batterie al litio ad alte prestazioni, ma a un costo notevolmente inferiore.
Tuttavia, i produttori di elettroliti stanno ottenendo risultati molto promettenti dalla ricerca e dallo sviluppo in corso che, ad un certo punto, risulteranno in elettroliti che funzioneranno bene in una cella di batteria LNMO. https ://blog.topsoe.com/the-cathode-material-for-next-generation-lithium-ion-batteries-is-ready
Più recentemente, aumentando il contenuto di Ni e abbassando o eliminando il contenuto di cobalto nei catodi NMC sta diventando molto più importante [Li, W., Erickson, E. & Manthiram, A. High-nickel layered oxide cathodes for lithium-based automotive batteries, Nat. Energy 5, 26-24(2020)].
Ossidi di poli-anioni - materiali catodici nella batteria agli ioni di litio
La terza classe di ossidi è quella dei polianioni. Gli ossidi di polianione come Fe2(MoO4)3 e Fe2(WO4)3 sono stati trovati per subire l’inserimento/estrazione reversibile di due ioni di litio per unità di formula per dare Li2Fe2(MoO4)3 o Li2Fe2(WO4)3 sia con metodi chimici che elettrochimici
[Manthiram, A., Goodenough, J. B. Inserzione di litio in quadri Fe2(MO4)3 : confronto di M = W con M = Mo. J. Chimica dello Stato Solido. 71, 349–360 (1987)].
Basato sulle opere di Manthiram e Goodenough,
[Manthiram, A. & Goodenough, J. B. Inserimento del litio in quadri Fe2(MO4)3: confronto tra M = W e M = Mo. J. Chimica dello Stato Solido. 71, 349-360 (1987). Manthiram, A. & Goodenough, J. B. Inserimento del litio nel quadro Fe2(SO4)3. J. Power Sources 26, 403-406 (1989)].
L’esplorazione dei fosfati contenenti litio come catodi ha portato all’identificazione dell’olivina LiFePO4 come catodo [Padhi, A. K., Nanjundaswamy, K. S. & Goodenough, J. B. Phospho-Olivines as positive electrode materials for rechargeable lithium batteries. J. Electrochem. Soc. 144, 1188-1194 (1997) in 1997.
Ma, la classe degli ossidi di polianioni soffre di scarsa conducibilità elettronica. [Arumugam Manthiram, Nature Communications (2020) 11:1550] .
L’esplorazione dei fosfati contenenti litio come catodi ha portato all’identificazione dell’olivina LiFePO4 come catodo [Padhi, A. K., Nanjundaswamy, K. S. & Goodenough, J. B. Phospho-Olivines as positive electrode materials for rechargeable lithium batteries. J. Electrochem. Soc. 144, 1188-1194 (1997) in 1997.
Ma, la classe degli ossidi di polianioni soffre di scarsa conducibilità elettronica. [Arumugam Manthiram, Nature Communications (2020) 11:1550] .
Fabbricazione di materiali catodici - batteria agli ioni di litio
In precedenza, i composti catodici di ossido di metallo di litio erano fatti da carbonato di litio e un sale del metallo scelto per mezzo di una serie di reazioni chimiche di sostituzione eseguite in soluzione. Il prodotto desiderato viene precipitato ed essiccato a spruzzo.
LiCoO2 è stato prima preparato con il metodo di sintesi convenzionale indicato nella figura. Il tetraossido di tricobalto (Co304) e il carbonato di litio (Li2CO3) sono stati mescolati bene, seguiti dalla calcinazione nel flusso d’aria ad una temperatura di circa 950ºC. Con questo metodo, tuttavia, era molto difficile preparare particelle grossolane di LiCoO2 e si potevano ottenere solo particelle fini con diametri di 1-3 pm.
I materiali per elettrodi attivi fini non sono desiderabili dal punto di vista della sicurezza. Nel caso di abusi come il cortocircuito esterno o lo schiacciamento, le particelle fini con grande superficie specifica reagiscono facilmente in una sola volta e tutta l’energia della cella viene bruscamente rilasciata in un tempo molto breve con un aumento della temperatura di accompagnamento. Nel caso peggiore, la cella può prendere fuoco [Yoshio Nishi, in Lithium ion Batteries, M. Wakihara and 0. Yamamoto (Eds.). pagina 192-193].
Come viene prodotta la batteria agli ioni di litio? diagramma di flusso
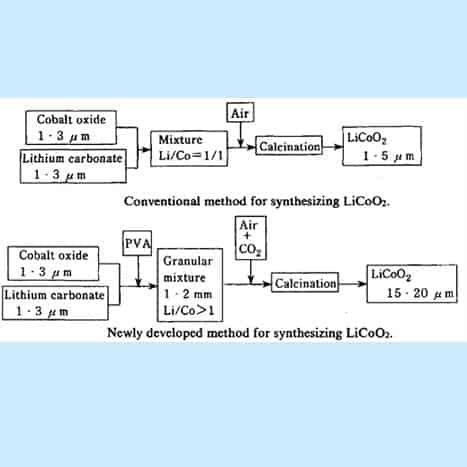
Figura 15. Diagramma di flusso per fare Li-CoO2
[Credito: Yoshio Nishi, in Batterie agli ioni di litio, M. Wakihara e 0. Yamamoto (Eds.). pagina 192-193].
Un processo migliorato per sintetizzare cobaltoite di litio di dimensioni maggiori: Il primo punto è che una piccola quantità di resina PVA viene aggiunta nelle miscele di materie prime (Co304 e Li2CO3)) per formare pellet granulari con un granulatore. Sinterizzando i pellet in un flusso d’aria contenente una quantità adeguata di gas C02, vengono sintetizzate particelle di cobalto di litio con un diametro medio di 20pm. Il secondo punto è che usiamo una quantità leggermente eccessiva di carbonato di litio (Li2CO3) nelle materie prime, quindi il rapporto atomico Li/Co nelle materie prime è maggiore di uno. Questa procedura è anche favorevole per ottenere particelle grossolane, e inoltre, il LiCoO2 risultante contiene una piccola quantità di Li2CO3 residuo.
Il primo punto è che una piccola quantità di resina PVA viene aggiunta nelle miscele di materie prime (Co304 e Li2CO3) per formare pellet granulari con un granulatore. Per sinterizzazione l’ossido di cobalto di litio può essere facilmente preparato dalla cottura ad alta temperatura di una miscela stechiometrica di carbonato di litio Li2CO3 e ossido di cobalto, Co3O4 o cobalto metallico a 600-800°C, quindi ricottura del prodotto a 900°C per molte ore, il tutto in atmosfera di ossigeno.
Si può anche ottenere per calcinazione dell’ossido idrato con idrossido di litio fino a 750-900°C.
Un terzo metodo utilizza acetato di litio, acetato di cobalto e acido citrico in quantità molari uguali, in soluzione acquosa. Il riscaldamento a 80°C trasforma la miscela in un gel trasparente e viscoso. Il gel essiccato viene poi macinato e riscaldato gradualmente a 550°C. (https: //en.wikipedia.org/wiki/Lithium_cobalt_oxide).
Alcuni esempi tipici sono: Metodo sol-gel
In un processo sol-gel, le soluzioni acquose dei reagenti e una soluzione di agente chelante sono mescolate. Una lenta evaporazione del solvente genera un sol e un moderato riscaldamento del sol così ottenuto produce un gel. Quest’ultimo viene calcinato a temperatura adeguata per ottenere il prodotto desiderato.
Esempio 1.
Sintesi di LiCoO2 da diversi agenti complessanti: I sali utilizzati sono stati il nitrato di cobalto esa idrato (Co(NO3)2.6H2O, e il nitrato di litio, LiNO3 anidro. Il gel è stato prodotto utilizzando quattro diversi agenti complessanti: acido citrico, anidro (C3H4OH(COOH)3, glicina, (H2NCH2COOH); amido (amido di mais commerciale e gelatina).
Si preparano cinque soluzioni contenenti LiNO3 e Co(NO3)2.6H2O in 20 ml di acqua, con una proporzione di Li:Co = 1,1:1. Ad ogni soluzione viene aggiunto un agente complessante specifico:(i) acido citrico (4,611 g) diluito in 5 ml di acqua;(ii) glicina (1,501 g);(iii) amido (1,250 g);(iv) gelatina (3,500 g) e(v) test in bianco.
Le prime quattro soluzioni sono state riscaldate a una temperatura di 70-80°C in un bagno di glicerina fino alla formazione del gel. Il tempo di questo processo è diverso per ogni gelificante:(i) acido citrico (5 ore),(ii) glicina (3 ore),(iii) amido (1 ora),(iv) gelatina (3 ore). La produzione di polveri cristalline per tutti i campioni è stata eseguita in due fasi in un forno a muffola: prima con la cottura dei materiali a 300°C per 20-30 minuti e successivamente il riscaldamento a 700°C per 24 ore. [Bruno G. A. Freitas e altri, J. Braz. Chem. Soc. 28, 11, Nov. 2017].
Esempio 2.
Preparato con un metodo Sol-Gel
Il LiNO3 viene prima sciolto in una soluzione di acido citrico. LiNO3, Ni(NO3)2.6H2O Co(Ac)2.4H2O e Mg(NO3)2.6H2O sono stati utilizzati come materiali di partenza di litio, nichel, cobalto e magnesio in LiNi0.7-𝑥M𝑥Co0.3O2(0 ⩽ 𝑥 ⩽ 0.1), rispettivamente. La quantità di acido citrico è uguale alla quantità molare totale di Co, Ni e Mg. Poi, Co(Ac)2 4H2O, Ni(NO3)2 6H2O e Mg(NO3)2 6H2O sono stati aggiunti alla miscela. L’intera miscela è stata riscaldata a bagnomaria a 80∘C. Durante il processo di riscaldamento, si è formata una soluzione chiara e rosa senza alcuna precipitazione. Alla fine, la soluzione chiara è stata lentamente asciugata e trasformata in gel. Lo xerogel è stato asciugato, macinato e poi trattato termicamente in un forno a 120°C per 12 ore.
Il precursore del gel è stato calcinato a 500°C in aria per 6 ore, e raffreddato a temperatura ambiente in un forno tubolare. I prodotti trattati termicamente sono stati macinati in un mortaio di agata per ottenere delle polveri. Poi la polvere è stata calcinata a 800°C per 12 ore. Per la fabbricazione dei catodi, i prodotti preparati sono stati prima mescolati con nero di acetilene e fluoruro di polivinilidene (80: 8:12 in peso) in 𝑁-metilpirrolidone (NMP). Lo slurry ottenuto è stato poi rivestito su un foglio di Al e asciugato a 80oC per 18 ore per un’ulteriore pressatura a rullo. . [Hailang Zhang, Advances in Materials Science and Engineering Vol 2014, Article ID 746341,]

Figura 16. Diagramma di flusso del processo sol-gel per preparare il manganato di litio
(Credito: Y.S. Lee, Y.K. Sun e K.S, Nahm, Solid State Ionics 109 (1998) 285 come dato da, M. Pasquali, S. Passerini e G Pistoia, in Batterie al litio, scienza e tecnologia, ed. di G. A. Nazri e G. Pistoia, Springer, New York, (2009), p. 318)
Fabbricazione di materiali anodici in batteria agli ioni di litio
Il percorso incoraggiante che porta alle LIB con una migliore energia e densità di potenza è la selezione di materiali anodici adatti che possono fornire alta capacità e facilità di diffusione degli ioni di litio nell’anodo, insieme a una buona durata del ciclo e senza problemi di sicurezza.
Sulla base dei materiali precursori, gli anodi di carbonio possono essere classificati in diversi tipi come indicato di seguito.
Il materiale precursore e i parametri di lavorazione determinano la natura del carbonio prodotto. I materiali che possono essere grafitizzati mediante trattamento ad alta temperatura (da 2000 a 3000°C) sono definiti
carboni morbidi
.
Dopo la grafitizzazione, il disordine turbostratico viene rimosso progressivamente con l’aumentare della temperatura, e la deformazione del materiale si alleggerisce [T. Zheng, J. N. Reimers e J. R. Dahn, Fisico. Rev. B 51, 734 (1995)]
Carbone duro
, come quelli preparati da resina fenolica, non possono essere facilmente grafitizzati, anche se trattati a 3000°C. I materiali di tipo coke sono preparati a circa 1000°C, tipicamente da un precursore di petrolio aromatico [Jeff Dahn e Grant M. Ehrlich. “Batterie agli ioni di litio”, Linden’s Handbook of Batteries,4a edizione, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26., 2011]

Figura 17. Classificazione dei precursori dei materiali anodici al carbonio
[Credito: Jeff Dahn e Grant M. Ehrlich. “Batterie agli ioni di litio”, Linden’s Handbook of Batteries,4a edizione, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26., 2011]
Goriparti divide i materiali anodici delle LIB in
tre categorie
seconda del loro meccanismo di reazione con il litio [Subrahmanyam Goriparti, Ermanno Miele, Francesco De Angelis, Enzo Di Fabrizio, Remo Proietti Zaccaria, Claudio Capiglia, J Power Sources 257 (2014) 421-443]
Il gruppo di intercalazione/de-intercalazione
Questa categoria di anodi comprende materiali carbonacei e ossidi di titanio. La capacità di stoccaggio che si verifica attraverso un percorso di intercalazione è strettamente associata all’area superficiale, alla morfologia, alla cristallinità e al suo orientamento. I carboni morbidi sono comunemente ben accettati e utilizzati nell’industria delle batterie. Si è visto che il carbonio morbido è una tecnologia abbastanza matura, mentre il carbonio duro può presentare una soluzione alternativa interessante soprattutto per le applicazioni che richiedono alta capacità come nel settore dei veicoli elettrici. Gli anodi di ossido di titanio sono già utilizzati da alcune industrie di batterie.


Anche il grafene è stato ampiamente rivisto. In particolare, si è visto che le loro proprietà elettriche rendono questo materiale particolarmente adatto per anodi ibridi grafene/metallo (per esempio grafene con SnO2 e Fe2O3). I nano-tubi di carbonio (CNT) sono stati significativi per i loro risultati accademici molto interessanti, anche se il costo di produzione potrebbe ostacolare la loro applicazione come materiale attivo anodico nell’industria delle batterie per il futuro.


Tuttavia, per le grandi batterie EV, le grafiti a basso costo sono normalmente preferite a causa di considerazioni sui costi.
In una seconda categoria, sono stati descritti materiali di lega come Si, Ge, SiO, SnO2. Questi materiali possono fornire capacità maggiori e alta densità di energia rispetto al gruppo precedente, reagendo con il litio in un meccanismo elettrochimico di lega/de-lega. Tuttavia, questo processo implica una grande espansione di volume che si traduce in una sostanziale perdita di capacità durante il ciclo. La riduzione dalle dimensioni di massa alla scala nanometrica, insieme alla realizzazione di strutture complesse attraverso la combinazione con matrici conduttive, è stata proposta per superare i problemi sopra specificati e per migliorare le prestazioni complessive dell’anodo.
Silicio e SnO2 e il loro composito con il carbonio sono i materiali più promettenti per le applicazioni nelle future batterie al litio, tuttavia, un modo economico per la loro produzione di massa come materiali anodici è ancora necessario. D’altra parte, il Ge, sebbene sia interessante per le sue proprietà elettrochimiche e gli eccellenti risultati sperimentali di laboratorio, soffre dell’inconveniente di essere il cinquantesimo elemento in termini di abbondanza nella crosta terrestre. Pertanto, non sembra essere una buona opzione per l’applicazione di massa della tecnologia delle batterie al litio.
Nel terzo gruppo, sono stati descritti materiali che reagiscono con il litio in un modo di reazione di conversione. In particolare, sono stati considerati ossidi metallici/fosfuri/nitri/solfuri. Tuttavia, questi materiali sono ancora lontani dal grande mercato commerciale delle batterie al litio, a causa della scarsa ritenzione della capacità e della grande isteresi potenziale. Pertanto, una varietà di forme nano-strutturate di questi materiali sono state anche studiate per affrontare i problemi sopra identificati.
La nanotecnologia è sicuramente un approccio formidabile per l’ingegneria della prossima generazione di materiali anodici per le batterie al litio. Al fine di utilizzare i materiali descritti come anodi efficaci nelle LIB commerciali, specialmente per le applicazioni EV, è comunque necessario un ulteriore lavoro di ricerca. Infatti, è necessario raggiungere sia una maggiore energia che una maggiore densità di potenza insieme allo sviluppo di processi di fabbricazione poco costosi per la sintesi su larga scala di materiali nanometrici. Inoltre, l’indagine dei meccanismi che regolano l’interazione tra il litio e le forme nanometriche dei materiali descritti insieme alle proprietà di trasporto degli elettroni all’interfaccia elettrodo/elettrolita è di fondamentale importanza per la progettazione della prossima generazione di materiali attivi anodici ingegnerizzati dalla nanotecnologia.
Gli elettrodi negativi attualmente impiegati nelle celle al litio comportano una soluzione solida di litio in una delle forme di carbonio. Le celle al litio che operano a temperature superiori al punto di fusione del litio devono necessariamente utilizzare leghe al posto del litio elementare. Si tratta generalmente di fasi metalliche binarie o ternarie. C’è anche un crescente interesse attuale nella possibilità di utilizzare leghe metalliche al posto dei carboni a temperatura ambiente, con l’obiettivo di ridurre il volume dell’elettrodo, oltre a raggiungere una capacità significativamente maggiore. [Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.123].
La grafite è anfotera, e sia i cationi che gli anioni possono essere inseriti tra gli strati di grafene. Quando i cationi sono inseriti, la struttura della grafite ospite assume una carica negativa. Esempi di cationi sono Li+, K+, Rb+ e Cs+. Quando si inseriscono degli anioni, la struttura della grafite ospite assume una carica positiva, ed esempi di anioni sono Br
–
SO2- , SbF6-
L’inserimento di metalli alcalini nel carbonio è stato dimostrato per la prima volta nel 1926 [ K. Fredenhagen e G. Cadenbach, Z. Anorg. Allg. Chem. 158, 249 (1926)] e la sintesi chimica di litio-carboni è stata dimostrata nel 1955 [D. Guerard, A. Herold, Carbon 13, 337 (1975)]. Raggi X Gli esperimenti di spettroscopia di fotoemissione hanno mostrato che il litio inserito cede il suo elettrone al carbonio, e quindi la struttura può essere vista come ioni Li+ contenuti tra gli strati di carbonio della struttura della grafite
[G.K. Wertheim, P.M.Th.M. Van Attekum e S. Basu, Solid State Commun. 33, 1127 (1980)]. Una rassegna generale dei primi lavori sull’inserimento di specie nella grafite può essere trovata in
[L.B. Ebert, Intercalation Compounds of Graphite, in Annual Review of Materials Science,
Vol. 6, ed. di R.A. Huggins, Annual Reviews, Palo Alto, CA (1976), p. 181].
Il fattore importante nella purezza del materiale anodico è la necessità di eliminare qualsiasi specie contenente ossigeno sulla superficie perché reagirebbe con l’elettrolita. Per evitare questa reazione, i produttori cuociono la grafite a 1100ºC) in atmosfere riducenti o inerti. Questo aumenta il costo per altri usi, rispetto alla grafite. Il carbonio (90%) è mescolato con diversi altri ingredienti per fare la pasta anodica o slurry. Come per il catodo, il fluoruro di polivinilidene (PVDF) è usato come legante (-5%), e una piccola quantità di nerofumo è aggiunta per assicurare la conduttività. Inoltre, l’n-metilpirrolidone (NMP) è usato per solubilizzare i materiali per formare una miscela uniforme. La pressione assicura una granulometria uniforme (Sandi 1999).
Il titanato di litio (LTO) sta guadagnando molto interesse. Le celle LTO funzionano a una temperatura più bassa rispetto ad altri prodotti chimici e offrono un’alta densità di potenza. Tuttavia, tali celle soffrono di avere una tensione nominale inferiore, nell’intervallo di circa 2,2-2,3 V per cella. [Norio Takami, Hiroki Inagaki, Yoshinao Tatebayashi, Hidesato Saruwatari, Keizoh Honda, Shun Egusa, J Power Sources 244 (2013) 469-475]
Il materiale dell’elettrodo, tipicamente la grafite, si espande del 10% durante il processo di carica. La grafite riacquista il suo volume originale quando gli ioni di litio si deintercalano. Gli ioni di litio non solo sarebbero intercalati nella grafite se si usa l’alluminio, ma anche inseriti nel conduttore, formando così una lega alluminio-litio. Il processo inverso si verificherebbe durante lo scarico. L’alluminio si degraderebbe dopo pochi cicli e sarebbe inutile come collettore di corrente.
Tuttavia, se l’elettrodo negativo è fatto di titanato di litio invece che di grafite, la situazione cambia radicalmente. Il potenziale dell’elettrodo di Li4Ti5O12 è circa 1,4 V superiore a quello della grafite (la tensione della cella è circa 1,4 V inferiore, 2,2 V contro 3,6 V). Questo impedirebbe agli ioni di litio di essere intercalati nell’alluminio. Pertanto, l’alluminio è preferito al rame per ragioni legate al costo e al peso. Li4Ti5O12 è impiegato principalmente in applicazioni stazionarie a causa della sua minore tensione di cella.[Călin Wurm et al., in Lithium-Ion Batteries, Reiner Korthauer (ed), Translated by Michael Wuest et.al., Springer, 2018. pp. 57].
Processo per la produzione di titanato di litio: Una miscela di biossido di titanio e un composto di litio (uno qualsiasi di questi: carbonato di litio, idrossido di litio, nitrato di litio e ossido di litio) viene presinterizzata a una temperatura compresa tra 670°C e 800°C. Si ottiene un composto costituito da TiO2 e Li2TiO3 o un composto costituito da TiO2, Li2TiO3 e Li4Ti5O12. Il composto viene poi sinterizzato a una temperatura compresa tra 800 e 950°C. [Tetsuya Yamawaki et al., U S Patent 6,645,673 B2, 2003 Assegnato a Toho Titanium Co., Ltd., Chigasaki]
Batteria ricaricabile SCiB™ di Toshiba (https://www.scib.jp/en/)
SCiB™ utilizza l’ossido di titanio di litio (LTO) nel suo anodo per ottenere sicurezza, lunga durata, prestazioni a bassa temperatura, ricarica rapida, alta potenza di ingresso/uscita e grande capacità effettiva. SCiB™ ha trovato ampie applicazioni nei veicoli, nell’industria e nelle infrastrutture, tra cui automobili, autobus, vagoni ferroviari, ascensori e centrali elettriche.
Produzione di separatori per batterie agli ioni di litio
Sono disponibili due tipi di processo: a umido e a secco. I produttori giapponesi usano un processo a umido in cui il polimero è dissolto nell’olio. L’olio viene poi evaporato per lasciare una pellicola porosa. Usano polimeri ad altissimo peso molecolare per produrre Celgard, tre strati di film polimerico soffiato sono laminati, tirati giù e ricotti sotto il punto di fusione per controllare la struttura del polimero. Il foglio viene poi allungato rapidamente per ottenere la porosità.
Sono disponibili due tipi di processo: a umido e a secco. I produttori giapponesi usano un processo a umido in cui il polimero è dissolto nell’olio. L’olio viene poi evaporato per lasciare una pellicola porosa. Usano polimeri ad altissimo peso molecolare per produrre Celgard, tre strati di film polimerico soffiato sono laminati, tirati giù e ricotti sotto il punto di fusione per controllare la struttura del polimero. Il foglio viene poi allungato rapidamente per ottenere la porosità.
[Pekala, R.W., et al., 2000, “Separators: An Overlooked Opportunity to Enhance Battery Performance?”, 17th International Seminar and Exhibit on Primary and Secondary Batteries, Ft. Lauderdale, Fla., March 6-9]
Questo processo è molto sensibile alle condizioni operative e varia anche con i lotti di materiale, quindi è necessario un attento controllo [Linda Gaines e Roy Cuenca, Cost of Lithium ion batteries for Vehicles, ANL Report ANL/ESD-42, maggio 2000, pp. 20 ].
Tuttavia, lo spessore aggiuntivo richiesto nei separatori per le celle EV/HEV compensa la resistenza ridotta. [Y. Nishi, in: M. Wakihara, O. Yamamoto (Eds.), Lithium Ion Batteries, Wiley/VCH/Kodansha, Tokyo, 1998, p. 195.
P. Arora, Z. Zhang, Chem. Rev. 104 (2004) 4419].
Oltre alle caratteristiche convenzionali come la buona resistenza meccanica, la permeabilità agli elettroliti, questi separatori microporosi mostrano una proprietà protettiva durante l’abuso delle cellule. Per esempio, se la temperatura della cella aumenta in modo anomalo a causa di un sovraccarico eccessivo, per esempio, il calore generato ammorbidisce il PE e chiude i micropori nella pellicola. Questo è chiamato
separatore “spegnimento”.
Una volta che si verifica lo spegnimento, il trasporto ionico tra gli elettrodi è effettivamente fermato e la corrente cessa di fluire. Se il separatore può mantenere l’integrità meccanica al di sopra della sua temperatura di spegnimento, può fornire un margine di sicurezza al dispositivo; altrimenti, gli elettrodi possono entrare in contatto diretto, reagire chimicamente, portando alla fuga termica.
Tuttavia, è possibile che a causa dell’inerzia termica la temperatura possa continuare a salire anche dopo lo spegnimento. In tali condizioni il separatore si fonderebbe e metterebbe in cortocircuito gli elettrodi, portando a reazioni violente e alla generazione di calore. Questo fenomeno è chiamato “fusione” o “rottura” del separatore. Quindi, per garantire la sicurezza della cella, la differenza tra la temperatura di “spegnimento” e quella di “fusione” dovrebbe essere la più grande possibile.
I separatori fatti interamente di polietilene ad alta densità si fondono a 135°C e perdono integrità meccanica al di sopra di questa temperatura. Tuttavia, i separatori realizzati laminando strati di polipropilene e polietilene mantengono l’integrità meccanica almeno fino a 165°C, il punto di fusione del polipropilene. È interessante notare che anche se il polietilene ad altissimo peso molecolare fonde a 135°C, i separatori fatti con questo materiale mantengono la loro integrità meccanica fino ad almeno 180°C, poiché la viscosità del materiale è tale da mantenere l’integrità fisica.
I separatori di spegnimento sono affidabili e i produttori di batterie agli ioni di litio stanno sempre più optando per la loro incorporazione nei loro prodotti. I separatori di arresto più comuni hanno polipropilene ad alto peso molecolare mescolato con polietilene ad altissimo peso molecolare. Qui, la proprietà unica di arresto del polietilene è combinata favorevolmente con l’alta integrità meccanica del polipropilene a temperature elevate. Poiché lo spegnimento è irreversibile, una volta attivati, questi separatori lasciano le cellule permanentemente danneggiate. [ P.G. Balakrishnan, R. Ramesh, T. Prem Kumar, J. Power Sources. 155 (2006) 401-414]
Altri materiali nella batteria agli ioni di litio
Ci sono altri materiali come collettori di corrente come fogli di alluminio, nichel e rame, leganti comecopolimero stirene-butadiene (SBR), efluoruro di polivinilidene (PVDF), elettroliti e solventi, additivi conduttivi del catodo, separatore.
Vantaggi e limiti della batteria agli ioni di litio - Produzione di celle agli ioni di litio
Rapporto peso anodo-catodo
È molto importante che non si formi litio metallico durante il funzionamento della cella. Il deposito del metallo forma dei dendriti che mettono in cortocircuito internamente la cellula. Il controllo della tensione durante la carica e il bilanciamento delle celle aiutano a ridurre questo problema in larga misura. Il metodo principale per controllare la deposizione di litio è il rapporto tra la capacità dell’anodo e quella del catodo delle singole piastre nella cella. L’elettrodo anodico ha circa il 10% in più di capacità utilizzabile rispetto al catodo. Questo impedisce il deposito di litio metallico sull’anodo durante la carica, poiché il catodo determina la capacità della cella. Se il litio metallico si deposita sulla superficie dell’elettrodo, reagisce con l’elettrolita e potrebbe iniziare la fuga termica.

Figura 21. Rapporto di capacità anodica e catodica nella cella a ioni di litio
(Credito: Ralph J. Brodd e Kazuo Tagawa, in Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk and Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 272, 2002).
Processi di assemblaggio delle celle agli ioni di litio
I processi di assemblaggio delle celle per una batteria agli ioni di litio richiedono precisione e accuratezza nel rivestimento dell’elettrodo positivo e negativo con il materiale attivo. Il processo di rivestimento è un elemento critico per garantire un prodotto ad alta capacità e ad alta affidabilità. Se i rivestimenti sono di scarsa qualità, si produrranno solo batterie a basso rendimento. I passi iniziali nella preparazione della massa attiva determinano il risultato.
Cohen e Gutoff [E. Cohen e E. Gutoff, Modern Coating and Drying Technology, Wiley-VCH,
New York, 1992] descrivono una metodologia per arrivare alla migliore tecnica di rivestimento per una particolare applicazione, basata sulla reologia dello slurry di rivestimento, sulla precisione richiesta e sulla velocità di rivestimento.

Figura 22. Processo di rivestimento anodico e catodico
(Credito: Ralph J. Brodd e Kazuo Tagawain in Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk and Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 273, 2002).
Diagramma di flusso per la fabbricazione della batteria agli ioni di litio

Figura 23. DIAGRAMMA DI FLUSSO PER LA FABBRICAZIONE DI CELLE AGLI IONI DI LITIO
[Ralph J. Brodd e Kazuo Tagawa in Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk and Bruno Scrosati (Eds.), Kluwer Academic Publishers, New York, pp. 271, 2002].

Credito: Electropaedia https: //www.mpoweruk.com/battery_manufacturing.htm
Figura 24. Diagramma di flusso per la fabbricazione di elettrodi da materie prime
Gruppo di celle agli ioni di litio




I produttori di batterie agli ioni di litio mirano ai seguenti punti durante l’assemblaggio delle celle:
- I progetti per la cella agli ioni di litio devono risultare in una densità di corrente uniforme in tutta l’area dell’elettrodo.
- Per assicurare un buon contatto tra i materiali attivi (AM) e il collettore di corrente
- Gli elettrodi di grande superficie sono impiegati per dare alle celle un’alta performance di velocità. Questo riduce la polarizzazione, cioè le perdite di tensione dovute alla cinetica delle reazioni degli elettrodi e abbassa la caduta di tensione attraverso il separatore.
La struttura dei pori e la combinazione di carboni conduttivi danno un buon contatto interparticellare del materiale attivo.
Unbuon contatto è essenziale tra i materiali attivi, il carbone conduttivo e il collettore di corrente, per il pieno utilizzo dei materiali attivi e per una buona efficienza durante le prestazioni ad alta velocità.
Lamiscela del catodo di cobalto è preparata da LiCoO2 (una polvere nera) + legante PVdF (un fluoropolimero termoplastico semicristallino bianco) + N-metilpirrolidone (NMP, un liquido organico incolore) come solvente. Essendo LICoO2 non conduttivo, viene aggiunto un diluente conduttivo, invariabilmente un nerofumo, per aumentare la conduttività di LiCoO2.
Il rapporto e le quantità dei materiali sono determinati dal design della cella e dalle dimensioni del miscelatore. Una procedura di miscelazione intensiva viene utilizzata per miscelare a secco il materiale attivo non conduttore e il carbonio prima di aggiungere il solvente di rivestimento e il legante.
La miscela viene mescolata a secco per ottenere un rivestimento uniforme delle particelle del materiale attivo con un sottile film di carbonio conduttivo in modo da migliorare il contatto elettrico tra l’AM e la griglia del collettore di corrente (foglio di alluminio, 20 mm di spessore), assicurando così il pieno utilizzo di tutta l’AM. Il polimero NMP è sciolto nel solvente di rivestimento in un contenitore separato. La miscela secca e la soluzione solvente sono poi combinati per formare uno slurry.
Leaggiunte di solvente servono a regolare la viscosità dello slurry (o della vernice) per l’operazione dirivestimento . Ilpolivinilendifluoruro (PVdF) è il legante di scelta e il Il solvente è l’N-metilpirrolidone (NMP). Il fango proveniente dall’operazione di miscelazione è posto in contenitori sigillati, che servono come serbatoio e mezzo di trasferimento per le operazioni di rivestimento. Quantità precise di fango di rivestimento sono pompate dal contenitore di stoccaggio con una pompa a ingranaggi o una pompa di precisione simile, per evitare qualsiasi trascinamento di aria nel fluido che va alla testa di rivestimento.
Lamiscela anodica è preparata in modo simile con carbonio duro, legante PVdF e NMP. Questa miscela è rivestita su un foglio di rame usato come griglia (10 mm di spessore).
Il rivestimento è fatto su entrambi i lati a circa 100 mm di spessore sia per gli anodi che per i catodi. Diminuendo lo spessore del rivestimento si ottiene un aumento della superficie totale per un determinato volume della cella. Gli elettroliti organici utilizzati possiedono una conduttività inferiore rispetto a quelli acquosi e quindi questa maggiore superficie faciliterà una cella di scarica ad alta potenza.
Lo spessore dell’elettrodo dipende dalla potenza massima richiesta. Una caratteristica unica della tecnologia di produzione delle batterie agli ioni di litio è che permette una vasta gamma di progetti di rapporto potenza/energia con la stessa tecnologia di produzione degli elettrodi [Broussely, Nazri pp 651]. Ma la raccolta di corrente adatta e la tabulazione, la forma delle celle e il design sono importanti.
Assemblaggio della cella: La lamina rivestita passa attraverso un forno per far evaporare il solvente e lasciare una quantità precisa di massa attiva sulla lamina. Molti solventi di rivestimento sono classificati come pericolosi e non possono essere rilasciati nell’atmosfera. Come misura di risparmio, il solvente viene generalmente recuperato per essere riutilizzato nel processo. Per evitare qualsiasi contaminazione dell’ambiente, il solvente può essere incenerito.
La maggior parte delle celle agli ioni di litio sono di forma cilindrica. Il rotolo di gelatina viene appiattito per ottenere elementi per celle prismatiche.
Le celle prismatiche sono favorevoli a un migliore riempimento del volume, ma sono suscettibili di rigonfiamenti durante il ciclismo o l’invecchiamento. Le lattine a celle cilindriche offrono una migliore resistenza meccanica, una buona stabilità dimensionale e una pressione uniforme negli elementi.
L’operazione di rivestimento produce un rivestimento interrotto che corrisponde alla lunghezza della bobina. Le macchine di avvolgimento sono progettate per funzionare automaticamente per l’uso con rotoli jumbo essiccati di catodi e anodi e separatore (25 mm o meno di spessore, PP o PE o misto).
Le operazioni iniziano con la saldatura delle linguette sulla sezione non rivestita delle lamine. La macchina avvolgitrice taglia quindi la striscia alla lunghezza appropriata e avvolge la combinazione anodo-separatore-catodo in una bobina stretta o bobina a gelatina. Man mano che il nucleo avvolto aumenta di diametro, la macchina avvolgitrice compensa automaticamente per mantenere una tensione costante man mano che la bobina aumenta di diametro per una stretta tolleranza sul diametro. Il vento ellittico per le celle prismatiche è un processo più complesso e più lento.
Dopo l’avvolgimento, la bobina viene controllata per i corti interni prima di essere inserita nella lattina. Le lattine di acciaio dovrebbero essere pulite e nichelate per fornire una superficie stabile e minimizzare la corrosione delle lattine prima dell’assemblaggio della cella. Il cavo anodico è saldato al fondo della lattina e il cavo catodico è saldato allo sfiato di sicurezza. L’elettrolita viene aggiunto alla cella semi-assemblata. L’assemblaggio è finito con la crimpatura del coperchio superiore.
Il rifiuto precoce dei potenziali difetti delle cellule è una misura economica ed evita un maggior lavoro sulle cellule difettose. La bobina è inserita nella lattina in modo che questa fornisca una pressione costante per tenere vicini i componenti dell’elemento, eliminando così qualsiasi possibilità di vuoti tra di essi. Alcuni produttori possono inserire un mandrino per stabilizzare il centro della bobina.
A meno che tutte le operazioni siano effettuate in un
stanza asciutta o box asciutto
l’acqua assorbita nei materiali attivi deve essere rimossa mediante calore e vuoto prima del processo di riempimento dell’elettrolita.
Il riempimento di precisione sotto vuoto dell’elettrolita è fatto per assicurare che l’elettrolita permei e riempia completamente la porosità disponibile nelle strutture del separatore e dell’elettrodo. Le pompe di precisione misurano il volume calcolato di elettrolito necessario per un buon funzionamento della cella. Invariabilmente tutti i produttori impiegano LiPF6 (un composto cristallino bianco inorganico) come elettrolita e i carbonati ciclici (EC, carbonato di etilene) o lineari (DMC, carbonato di dimetile, DEC, carbonato di dietile, o EMC, carbonato di etile-metile, etc.) sono i solventi per questo sale elettrolitico.
Gli elettroliti basati su miscele di solventi di carbonato di etilene (EC) con dimetil carbonato (DMC) e/o dietil carbonato (DEC) sono comunemente usati per le batterie agli ioni di litio in combinazione con catodi “4 V” (cobalto, nichelato e manganato) a causa dell’alto potenziale di ossidazione dei solventi.
Dopo aver riempito la cella con l’elettrolita, la cella viene sigillata dalla compressione controllata di una guarnizione polimerica o di un gommino posto tra la lattina della cella e la piastra superiore. La pressione sulla guarnizione di tenuta in polimero è controllata per mantenerla entro il limite elastico del polimero. Se i limiti elastici vengono superati, il polimero scorre a freddo e compromette la tenuta.
Ogni produttore usa una costruzione meccanica un po’ diversa per sigillare le celle, ma i risultati finali sono essenzialmente identici. In genere, si forma una spalla o una sporgenza vicino alla parte superiore della cella. Questo serve come base per la guarnizione e per tenere il rotolo di gelatina in posizione e prevenire la telescopia o il cambiamento di posizione della bobina avvolta sotto l’influenza di vibrazioni e urti.
Qualsiasi spostamento nella posizione causa un cambiamento nella distribuzione della corrente e si traduce in una scarsa durata del ciclo o nella placcatura del litio nelle celle ad alte prestazioni. La guarnizione della piastra superiore della cella contiene uno sfiato, un elemento a coefficiente di temperatura positivo (PTC) e un dispositivo di sicurezza ad interruzione di corrente (CID). Sia il CID che il PTC sono dispositivi di sicurezza progettati per attivarsi e prevenire lo sviluppo di temperature e pressioni pericolose all’interno della cella. Ogni lotto di dispositivi è controllato per il corretto funzionamento prima di essere incorporato nel gruppo superiore.
Dopo l’applicazione del sigillo, le cellule possono essere lavate, rivestite ed etichettate. Hanno un numero di serie per risalire al giorno di fabbricazione e per identificare tutti i componenti della cella (materiali dell’elettrodo, elettrolita, separatore e simili). Le informazioni sulla capacità e la tensione vengono memorizzate con il numero di cella e utilizzate in seguito per abbinare le celle per l’assemblaggio del pacco.
Le celle possono essere saldate al laser con guarnizioni vetro-metallo per fornire guarnizioni ermetiche di lunga durata. Con le celle più grandi, è necessario prestare maggiore attenzione per garantire un funzionamento sicuro, anche in condizioni di abuso.
Mentre i processi di cui sopra sono rappresentati per le piccole celle sigillate usate nell’elettronica portatile, il processo per le batterie industriali più grandi per l’immagazzinamento di energia, lo spazio e le applicazioni EV seguono lo stesso schema generale.
Batteria agli ioni di litio - Formazione e invecchiamento
Come assemblato, gli ioni Li non sono drogati nel carbonio anodico e quindi la cella non mostra alcuna tensione. Durante la carica iniziale, una parte degli ioni Li dal PAM LiCoO2 è drogata per diventare Li1-xCoO2 e questi ioni di litio sono drogati nell’anodo di carbonio (Cy) per diventare LixCy. Quando la tensione di carica raggiunge i 4,1-4,2 V, il valore di x è circa 0,5. (cioè il 50%) che indica che è stato usato il 50% di Li da LiCoO2.
Un altro aspetto da notare è che una parte degli ioni di litio drogati non ritorna e rimane nell’anodo. dove, x-dx Gli ioni di litio rimangono senza contribuire alla capacità. Si tratta di circa il 10-20% di litio irreversibile, il che significa che l’efficienza della carica iniziale è dell’80-90%. A partire dal secondo ciclo, la quantità irreversibile non aumenta e la cella mostra il 100% della capacità progettata dal produttore.
Dopo il lavaggio e l’incamiciatura, ma prima dell’inizio del processo di formazione, la tensione e l’impedenza di tutte le celle sono registrate per selezionare eventuali celle difettose. Le celle vengono poi caricate per la prima volta
(carica iniziale o carica di formazione). Le condizioni della prima carica sono importanti per almeno due ragioni:
1) lo strato di interfase dell’elettrolita solido (SEI) si forma sull’anodo per proteggerlo dalla reazione spontanea con l’elettrolita durante il normale funzionamento della cella, e 2) stabilisce il buon contatto elettrico tra i materiali attivi e l’elettrolita. La prima carica segue la procedura raccomandata dal produttore per caricare le celle, ma spesso inizia con una corrente più bassa e poi aumenta fino alla normale corrente di carica a circa un terzo della durata della carica. Le celle possono continuare a pedalare entro i limiti di tensione per la carica e la scarica per uno o due cicli in più dopo la formazione.
Dopo la formazione o il ciclo, la tensione e la capacità della cella sono misurate e memorizzate per un uso successivo nel processo di selezione della cella. Il periodo di invecchiamento varia tra due settimane e un mese, a seconda del produttore. La tensione delle celle è misurata di nuovo dopo lo stoccaggio. Le differenze di tensione all’inizio e alla fine del periodo di stoccaggio sono utilizzate per selezionare le celle con “soft-” o “micro-” corti. Le celle con corti interni avranno una tensione più bassa dopo lo stoccaggio e si separeranno dalla normale distribuzione della tensione e della capacità. Può essere necessario evacuare le celle più grandi dopo la formazione per rimuovere i gas di formazione.
Per una descrizione dettagliata del processo di assemblaggio, si rimanda il lettore a
- Kaoru Nakajima e Yoshio Nishi Capitolo 5 in: Energy Storage Systems for Electronics, Ed Tetsuya Osaka e Madhav Datta, Gordon and Reach Science Publishers, Amsterdam, 2000.
- Lithium-Ion Cell Production Processes, Ralph J. Brodd e Kazuo Tagawa, Capitolo 9 in: Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk and Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 273, 2002.
- Batterie al litio, scienza e tecnologia, ed. di G. A. Nazri e G. Pistoia, Springer, New York, 2009.
- Batterie agli ioni di litio, Reiner Korthauer (ed) (2018), Tradotto da Michael Wuest et.al., Springer, 2018.
- Kazuo Tagawa e Ralph J. Brodd, Production Processes for Fabrication of Lithium-Ion Batteries in Lithium-Ion Batteries, Yoshio M., Brodd R.J., Kozawa A. (eds) Springer, New York, NY. https: //doi.org/10.1007/978-0-387-34445-4_8]
- Zhang Z., Ramadass P. (2012) Sistemi di batterie agli ioni di litio e tecnologia. In: Meyers R.A. (ed) Encyclopaedia of Sustainability Science and Technology. Springer, New York. https: //doi.org/10.1007/978-1-4419-0851-3_663
- The Handbook of Lithium-Ion Battery Pack Design Chemistry, Components, Types and Terminology, John Warner, Elsevier, 2018




