Comment fonctionne une batterie lithium-ion
La perception dans le domaine public est que les batteries au plomb sont une vieille technologie. La batterie lithium-ion a une perception différente, elle est moderne, plus propre, elle a une densité énergétique 3 ou 4 fois supérieure et une durée de vie plus longue. Dans ce contexte, quels sont les avantages possibles de la technologie plomb-acide vieille de 150 ans ? En fait, tout n’est pas aussi simple qu’il n’y paraît. Il suffit de regarder derrière les gros titres les données utilisées dans les affirmations commerciales, puis d’appliquer un peu de bon sens, de recherche fondamentale et de science rudimentaire. Vous constaterez que la réalité est assez différente.
La première idée fausse concerne les densités énergétiques volumétrique et spécifique. Les valeurs vedettes de 4 à 5 fois ne concernent que la densité d’énergie spécifique et un nombre limité de chimies de batteries lithium-ion, dont certaines ne sont pas encore utilisées dans le commerce. Fig. 2 compare plusieurs cathodes pour les cellules de batteries lithium-ion ; elles vont d’environ 100Wh/kg pour la chimie Li-FePO4 la plus sûre à plus de 200Wh/kg pour la variante nickel-cobalt-oxyde d’aluminium. Le schéma d’une batterie plomb-acide est donné ci-dessous :


Ces valeurs ne s’appliquent qu’au niveau de la cellule unique, et non au pack ou à l’état en service. Fig. 3 montre les densités énergétiques de différentes batteries chimiques au niveau des cellules et du système. Les densités énergétiques des cellules de batteries lithium-ion sont pratiquement divisées par deux lorsqu’elles sont entièrement installées avec tous les équipements de connexion, de refroidissement, de sécurité et de gestion de la batterie.
L’avantage au niveau de la cellule de 3 à 5 fois la densité d’énergie spécifique est réduit à 2 à 3 fois. En fonction de la chimie de la cathode de lithium, nous pourrions presque envisager une parité entre les batteries lithium-ion et les batteries plomb-acide en termes de densité énergétique pour un système de batteries entièrement installé dans certaines applications.
L’autre facteur, celui de la durée du cycle, est également source de confusion. Combien de cycles une batterie au lithium-ion peut-elle effectuer avant que sa capacité ne tombe en dessous de 80 % de sa valeur nominale ? Deux, trois mille ? Le tableau 1 présente un résumé des différents matériaux de cathode Li-ion en termes de performance et de durée de vie.
Avantages de la chimie des batteries plomb-acide
Les batteries sont des appareils étranges. Personne n’en veut, mais tout le monde en a besoin. Ils ne sont achetés qu’en cas de besoin. Combien de personnes prévoient de se rendre au centre commercial local pour acheter des piles ? Ils sont achetés par rancune et ne sont achetés qu’en cas de nécessité absolue. Un bon vendeur peut vous vendre deux paires de chaussures, deux voitures et peut-être deux maisons si vous avez l’argent, mais il ne peut pas vous vendre deux batteries automobiles SLI. Lorsque vous achetez une batterie, qu’il s’agisse d’une batterie solaire pour un panneau solaire, d’un vélo électrique, d’un système d’alimentation sans coupure et d’un onduleur de secours ou d’une batterie de traction pour chariots élévateurs, ne souhaitez-vous pas en savoir plus ?
Comment fonctionnent les batteries au plomb, quelles sont les différences entre les types et les modèles, et quelles sont les différentes chimies ? Ils peuvent être coûteux. Dans une application commerciale ou domestique, quel est le retour sur investissement, la durée de vie et le coût de remplacement d’une batterie au plomb ? La taille dont vous avez besoin, l’espace disponible, l’efficacité énergétique de la batterie au plomb et le temps de recharge ? Et puis, il y a les coûts cachés de la sécurité, de l’élimination et de l’empreinte carbone. Cet article compare les batteries plomb-acide et les batteries lithium-ion et aborde un grand nombre d’idées fausses associées à ces deux produits chimiques.
Quelle batterie lithium-ion est la meilleure
| Matériau de la cathode | Nom court | Tension nominale | Énergie spécifique Wh/kg (cellule) | Durée du cycle | Commentaires |
|---|---|---|---|---|---|
|
Oxyde de lithium et de cobalt (LiCoO2) |
LCO | 3.6 | 150-200 | 500-1000 | Dispositifs portables - emballement thermique en cas de surcharge |
| Oxyde de manganèse et de lithium (LiMn2O4) | LMO | 3.7 | 100-150 | 300-700 | Outils électriques, dispositifs médicaux - plus sûrs que le LCO |
| Oxyde de lithium, nickel, manganèse et cobalt (LiNiMnCO2) | NMC | 3.6/3.7 | 150-220 | 1000-2000 | Vélos électriques, véhicules électriques, industrie - durée de vie élevée. |
| Phosphate de fer lithié (LiFePO4) | LFP | 3.2 | 90-120 | 1000-2000 | EV, SLI, Leisure - la plus sûre de toutes les batteries lithium-ion. |
| Oxyde de lithium-nickel-cobalt-aluminium (LiNiCoAlO2) | NCA | 3.6 | 200-260 | 500 | Industriel, groupe motopropulseur EV (Tesla) TR à 150C, CL 500 |
| Titanate de lithium (Li4Ti5O12) | LTO | 2.4 | 50-80 | Onduleurs, panneaux solaires, groupes motopropulseurs pour véhicules électriques (Honda, Mitsubishi). CL 3000-7000 - très sûr |
Comme on peut le constater, tous se situent dans la fourchette de 800 à 2000 cycles. En comparaison, une batterie au plomb bien conçue peut facilement atteindre plus de 1600 cycles à 80% de DOD. Comment tout cela se traduit-il en termes de coût de possession ? Cela nous amène au point suivant, à savoir le prix des batteries au plomb. Combien coûte une batterie lithium-ion par rapport à une batterie plomb-acide ? Coût d’une usine de fabrication de batteries lithium-ion ? Naturellement, la batterie lithium-ion est plus chère, mais de combien. Là encore, cela dépend du niveau envisagé. Les communiqués de presse nous diront que les prix de l’ion-lithium sont en baisse et qu’ils sont maintenant de l’ordre de 2 à 3 fois ceux de l’acide-plomb.
Vraiment ? Les prix moyens obtenus lors d’une récente recherche sur Internet au Royaume-Uni pour obtenir les prix des batteries de loisirs de 12V et 100 Ah disponibles dans le commerce, tant pour les batteries lithium-ion que pour les batteries plomb-acide :
batterie lithium-ion 960 $ ou 800 $/kwh
Batterie au plomb 215 $ ou 180 $/kwh
Il est évident que la durée de vie de la batterie lithium-ion doit être 4 fois supérieure à celle de la batterie plomb-acide équivalente pour obtenir la même valeur. Comme nous l’avons vu, ce n’est pas le cas.


Dans tous les cas, la construction d’une batterie au plomb s’est avérée la plus rentable, même lorsqu’une batterie au plomb de plus grande taille a été installée pour offrir une meilleure acceptation de la charge et une plus longue durée de vie. Dans cet exemple, l’application était une tour de télécommunication en Inde. Le même principe s’applique à la plupart des applications et des zones géographiques, et plus encore aux climats froids. L’autre idée fausse est que le Li-ion est une technologie plus propre et moins polluante que le plomb-acide. Les émissions du berceau à la porte pour différents types de batteries sont indiquées dans les figures. 5 et 6.
Cette figure montre les limites des opérations pour la fabrication des batteries. Depuis l’extraction et le transport des matières premières jusqu’au moment où les batteries sont prêtes à être expédiées, en passant par toutes les étapes de transformation.
Le tableau 2 est une situation réelle comparant les aspects économiques de l’utilisation d’une batterie lithium-ion et d’une batterie plomb-acide fonctionnant sur des périodes de vie différentes.
| Élément de coût | Frais de fonctionnement quotidiens USD | Frais de fonctionnement quotidiens USD |
|---|---|---|
| 3 ans | Batterie au plomb | Batterie lithium-ion |
| Amortissement | 8.30 | 16.90 |
| Diesel (livré) | 15.50 | 15.50 |
| Maintenance | 2.46 | 2.46 |
| Électricité | 1.47 | 1.47 |
| Chargement de la batterie | 0.65 | 0.50 |
| Total jour/mois | 28.38/851 | 36.83/1105 |
| 6 ans | ||
| Amortissement | 5.86 | 8.46 |
| Diesel | 15.50 | 15.50 |
| Maintenance | 2.46 | 2.46 |
| Électricité | 1.47 | 1.47 |
| Chargement de la batterie | 0.54 | 0.50 |
| Total jour/mois | 25.83/775 | 28.39/852 |
Ces données, fournies par les laboratoires nationaux Argonne, montrent que le processus de fabrication total, y compris l’extraction et le transport des matières premières pour les batteries lithium-ion, est plus de 4 fois supérieur à celui de l’acide-plomb. En ce qui concerne l’extraction des matériaux, l’approvisionnement en matériaux cathodiques de base tels que le cobalt et le manganèse et le lithium n’est pas totalement certain. Les procédés d’extraction et de récupération existent, mais le nombre de mines et de sites de fabrication risque de limiter l’offre si la demande augmente considérablement. La carte géopolitique prévoit également une incertitude pour certaines sources de ces matériaux.
Les piles au lithium-ion sont-elles recyclables ?
La recyclabilité et la sécurité de ces produits chimiques sont des facteurs importants. On sait que presque tous les composants des batteries au plomb sont recyclés à 100 %, alors qu’il n’existe aucun procédé commercial pour le recyclage des batteries au lithium-ion. Cette situation est compréhensible si l’on considère que les composants les plus coûteux (Li, Co, Mn, etc.) ne représentent qu’une petite fraction de la batterie lithium-ion totale. Par exemple, le lithium représente environ 4 % du poids total de la cellule. Ajoutez à cela le fait évident que le lithium est très réactif (ce qui explique sa haute densité énergétique), ce qui rend son extraction des déchets coûteuse.
Le facteur supplémentaire de complexité, avec de nombreux matériaux différents dans sa construction, rend le recyclage difficile, tant sur le plan technique qu’économique. Le résultat ? Il n’y a tout simplement aucune incitation commerciale à recycler ces piles. C’est pourquoi les installations de recyclage en sont encore au stade pilote et sont pour la plupart financées par le gouvernement.
À l’heure actuelle, la grande majorité des batteries au lithium-ion mises au rebut sont stockées dans l’attente d’une percée technologique ou d’une législation imposant leur recyclage. Si cette dernière devait être mise en œuvre, il y aurait un coût, en définitive pour le consommateur. Cela augmenterait encore le prix de la cellule Li-ion par rapport aux types de batteries plomb-acide.
Une batterie lithium-ion peut-elle exploser ?
Enfin, nous avons la sécurité. À notre connaissance, aucune application de batterie plomb-acide n’a jamais fait l’objet d’un rappel de sécurité, comme c’est le cas pour les batteries Li-ion utilisées dans les appareils électroniques portables et même dans les véhicules électriques. Fig. 7 montre ce qui est arrivé à une nouvelle Volvo hybride au Royaume-Uni il y a quelques semaines, au moment de la rédaction de cet article. Dans ce cas, ses batteries lithium-ion ont pris feu lorsqu’elles étaient en charge.
Incendies de batteries au lithium-ion
Figure 7 Incendie provoqué par une batterie Li-ion dans un véhicule électrique hybride Volvo : Avril 2018-Résidence au Royaume-Uni


Cette vidéo montre un incendie très récent causé par une batterie au lithium. Peut-être à cause d’un déséquilibre dans les cellules et d’un mauvais BMS.
Même lorsqu’elles sont stockées ou transportées, les batteries lithium-ion ont été à l’origine d’incendies très dangereux. Bien que ces occasions soient rares, il faut les reconnaître et installer des équipements de sécurité et des logiciels de gestion de la batterie appropriés. Les pompiers de New York, par exemple, sont encore en train de décider comment faire face aux incendies de batteries lithium-ion. Cela suggère fortement que les mesures de sécurité existantes pour les batteries lithium-ion dans le monde doivent être revues.
Voici le point de vue des pompiers de New York :
Citation d’un article de presse : AWS utility drive 15 novembre 2016 « Le feu n’est pas le plus gros problème », a déclaré Rogers. Les pompiers sont formés pour faire face aux incendies, mais ils doivent savoir à quoi ils ont affaire. Les batteries Li-ion peuvent libérer des acides toxiques et des vapeurs inflammables. Certaines de ces vapeurs sont consumées par le feu, mais si elles ne le sont pas, elles peuvent s’enflammer ou constituer un problème pour les pompiers. Le plus gros problème est ce qui se passe « post-op », c’est-à-dire après que le feu soit éteint. Même si une batterie est éteinte, elle peut se rallumer pendant 72 heures, a précisé M. Rogers. -Lt. La division des opérations sur les matières dangereuses du service d’incendie de Paul Rogers de New York »
Batterie lithium-ion ou batterie plomb-acide ?
La batterie aux ions de lithium a certainement de meilleures caractéristiques de performance que l’acide de plomb. Toutefois, ces avantages sont fortement réduits par le matériel supplémentaire associé aux exigences de sécurité et de gestion. Le résultat net est que les batteries au plomb ont des avantages distincts, en particulier lorsque l’on considère des applications qui ne sont pas limitées par le poids ou l’acceptation de la charge. Le coût initial plus faible de l’usine de fabrication de batteries au plomb-acide ;
Le faible prix d’achat et le faible coût d’amortissement de l’acide de plomb, combinés à son faible impact sur l’environnement et à sa sécurité inhérente, offrent les avantages suivants :
- Prix d’achat plus bas. Le prix est environ un quart de celui d’un équivalent Li-ion. Les coûts d’exploitation plus faibles pour donner un coût total de possession plus bas dans la majorité des applications.
- Recyclabilité. Près de 100 % des matériaux des batteries au plomb sont recyclés. La valeur de la ferraille peut fournir un revenu supplémentaire allant jusqu’à 20 % du coût du matériau de la batterie. Les piles au lithium ne disposent d’aucune infrastructure ni d’aucun procédé commercial de recyclage.
- La sécurité. La chimie de l’acide de plomb est intrinsèquement plus sûre que celle de la batterie lithium-ion.
- La durabilité. Il existe de nombreuses sources d’approvisionnement bien établies pour l’acide de plomb, notamment à partir d’installations de recyclage. Le lithium et d’autres matériaux cathodiques peuvent être fournis à partir de zones politiquement sensibles. Les capacités mondiales actuelles d’extraction et de fabrication des matériaux ne permettraient pas d’augmenter rapidement la production de batteries au lithium-ion.
- Empreinte carbone. L’empreinte carbone de la fabrication des batteries au plomb est trois fois moins importante que celle des batteries au lithium-ion.
Un tableau différent de celui peint par les entreprises de batteries lithium-ion. Si l’on ne peut contester le fait que l’acide-plomb présente un désavantage en termes de densité énergétique, le fait est que la batterie à l’acide-plomb est toujours très sûre, compétitive et constitue le meilleur choix de technologie de batterie dans de nombreuses applications.
Qu'est-ce qu'une batterie lithium-ion ?
Matériaux de cathode et d’anode : Bien que les piles nickel-métal-hydrure (Ni-MH) aient été privilégiées au départ dans les années 1990, le premier produit commercial de batterie rechargeable lithium-ion au monde a été lancé en 1991 par Sony Corporation. En plus d’un contenu énergétique élevé, tant en masse qu’en volume, cette batterie offrait également d’excellentes caractéristiques à basse température, caractéristiques de charge et caractéristiques de cycle. En conséquence, il a rapidement conquis le marché et est devenu une source d’énergie indispensable pour les équipements audio et vidéo, les ordinateurs personnels, les téléphones portables et d’autres équipements portables.
La technologie avancée des batteries d’aujourd’hui a commencé avec la découverte de la haute conductivité ionique de la phase solide NaAl11O17, appelée β-alumine de sodium, par Kummer et ses collègues du laboratoire de la Ford Motor Co. [1. Olof Ramsrtomström, sur le prix Nobel de chimie, Contexte scientifique du prix Nobel de chimie 2019 ; 2. Y.F.Y. Yao et J.T. Kummer, J. Inorg. Nucl. Chimique. 29, 2453 (1967)].
On s’est alors rendu compte que le transport ionique dans les solides pouvait en fait être très rapide et qu’il pouvait déboucher sur toute une série de nouvelles technologies. Peu de temps après, les chercheurs de Ford ont montré que l’on pouvait utiliser un électrolyte solide hautement conducteur pour produire un type de batterie entièrement nouveau, en utilisant du sodium fondu à l’électrode négative et une solution fondue de sodium dans du soufre comme électrode positive, avec l’électrolyte solide conducteur de sodium entre les deux [N. Weber and J.T. Kummer, Proc. Annual Power Sources Conf. 21, 37 (1967) ].
Comme on pouvait s’y attendre, on a rapidement envisagé la possibilité de systèmes analogues au lithium, car il était reconnu qu’une pile au lithium équivalente devait produire des tensions plus élevées qu’une pile au sodium. En outre, le lithium a un poids inférieur à celui du sodium, ce qui constitue un autre avantage.
Le lithium élémentaire ne pouvait pas être utilisé, en raison de son faible point de fusion. Au lieu de cela, les alliages de lithium solides, principalement les systèmes Li/Si et Li/Al, ont été étudiés [R.A. Huggins, J. Power Sources 81-82, 13 (1999)].
Un certain nombre de matériaux ont été étudiés comme réactifs d’électrode positive à l’époque, avec une attention particulière portée à l’utilisation de FeS ou FeS2. Lors de la réaction avec le lithium, ces matériaux subissent des réactions de reconstitution, avec disparition des phases initiales et formation de nouvelles phases [D.R. Vissers, Z. Tomczuk et R.K. Steunenberg, J. Electrochem. Soc. 121, 665 (1974)].
Quand la batterie lithium-ion a-t-elle été inventée ?
Leprofesseur Whittingham a exploré l’intercalation électrochimique dans ces matériaux et, en 1973, a proposé ces matériaux comme électrodes dans les batteries. Ces travaux ont abouti à une batterie rechargeable fonctionnelle en 1976. La cellule réussie était composée de lithium métal comme anode et de sulfure de titane (TiS2) comme cathode, avec de l’hexafluorophosphate de lithium(LiPF6) comme électrolyte dans du carbonate de propylène (PC) comme solvant. Ces études prometteuses ont inspiré à Whittingham l’exploration de l’intercalation électrochimique dans ces matériaux comme électrodes dans les batteries. Une batterie rechargeable fonctionnelle a ensuite été démontrée en 1976.
[(a)Whittingham, M. S. Electrointercalation in Transition-Metal Disulphides. J. Chem. Soc. et Chem. Commun. 1974, 328-329.] (avec Exxon Research and Engineering Company).
(b)Whittingham, M. S. Batterie à Base de Chalcogénures. Brevet belge n° 819672, 1975.
(c)Whittingham, M. S. Electrical Energy Storage and Intercalation Chemistry. Science 1976, 192 (4244), 1126-1127.
Mais le succès a été de courte durée. Lors de cycles répétés, le lithium métallique a formé des dendrites à la surface du métal, entraînant des courts-circuits.
Ce problème a donné l’impulsion à une nouvelle recherche de solutions alternatives et une configuration de cellules à « transfert d’ions » (également appelée « rocking chair »), où les deux électrodes peuvent accueillir des ions, a été proposée.
Si un matériau d’électrode positive contient initialement du lithium et qu’une partie ou la totalité du lithium est éliminée lors de la première charge, la cellule développe un potentiel. Il est donc possible d’avoir des matériaux d’électrode positive qui réagissent avec le lithium à des potentiels supérieurs à environ 3V, s’ils contiennent déjà du lithium, et que ce lithium peut être extrait électrochimiquement.
Qui a inventé la batterie lithium-ion ?
Cette approche, qui consiste à utiliser des matériaux dans lesquels le lithium est déjà présent, a été démontrée pour la première fois par le professeur Goodenough. Les premiers exemples de matériaux contenant initialement du lithium, et supprimant électrochimiquement le lithium de ceux-ci, ont été les travaux sur Li1-xCoO2 en 1980.
[K. Mizushima, P.C. Jones, P.J. Wiseman et J.B. Goodenough, Mater. Res. Bull. 15, 783 (1980)] et Li1-xNiO2
[J.B. Goodenough, K. Mizushima et T. Takada, Jpn. J. Appl. Phys. 19 (Suppl. 19-3), 305 (1980)].
Parallèlement au développement de l’anode, de meilleurs matériaux de cathode ont également été recherchés afin d’obtenir une emf de cellule plus élevée en combinaison avec des anodes de potentiel plus élevé que le lithium métallique. Une percée a eu lieu en 1979/1980 lorsque John B. Goodenough et ses collègues à Oxford
University, au Royaume-Uni, ont découvert que le LixCoO2, un autre chalcogénure métallique intercalé de type MX2, pouvait servir de matériau de cathode.
[Goodenough, J. B. ; Mizushima, K. Fast Ion Conductors. Brevet américain n° 4,357,215, 1982].
[Mizushima, K. ; Jones, P. C. ; Wiseman, P. J. ; Goodenough, J. B. LixCoO2 (0<x<-1) : A New
Matériau de cathode pour les batteries à haute densité d’énergie. Mater. Res. Bull. 1980, 15 (6), 783-789].
La structure du matériau était analogue à celle du LixTiS2 avec des écarts de van der Waals entre le dioxyde de cobalt (CoO2) des couches dans lesquelles les ions lithium pourraient être liés sans grande expansion du réseau. Goodenough a raisonné que lorsque X dans MX2 est un petit élément électronégatif, le processus d’absorption de cations qui en résulte serait associé à un important changement d’énergie libre négative et à une tension cellulaire élevée (ΔG = -nFE). Avec un X d’oxygène, la situation a été jugée particulièrement prometteuse, compte tenu également du fait que les ions de lithium ont été proposés comme étant suffisamment mobiles dans les réseaux d’oxygène très compacts.
Le raisonnement s’est avéré correct, et le matériau CoO2 a montré un potentiel très élevé de ~4 à 5 V par rapport à Li+/Li. Les études électrochimiques ont été réalisées dans ce cas avec un électrolyte composé de tétrafluoroborate de lithium (LiBF4) dans du carbonate de propylène.
Cette découverte a permis d’utiliser des matériaux d’anode avec des potentiels plus élevés que le lithium métal, ce qui a fait avancer la recherche de matériaux carbonés appropriés. Compte tenu de la difficulté de résoudre le problème de l’intercalation électrochimique du graphite, d’autres options ont été étudiées à la place.
Où a été inventée la batterie lithium-ion ?
Une percée a été réalisée en 1985 lorsqu’un groupe japonais dirigé par Akira Yoshino (d’Asahi Kasei Corporation) a découvert les fibres de carbone produites en phase vapeur (VGCF), puis le coke de pétrole traité thermiquement. Ce dernier matériau était connu pour contenir un mélange de domaines cristallins (graphitiques) et non cristallins, et les chercheurs ont pu identifier des qualités particulièrement stables, mais très performantes, avec des degrés de cristallinité spécifiques.
[Akira Yoshino, The Birth of Li-Ion Battery, Angewandte Essays, Angew., Chem. Int. Ed., 2012, 51, 5798-5800]
Grâce à ces matériaux anodiques efficaces, Yoshino a mis au point une batterie lithium-ion efficace et fonctionnelle basée sur la configuration de la cellule de transfert d’ions. Le matériau carboné identifié a donc été utilisé comme anode et le matériau LixCoO2 de Goodenough (contenant généralement de petites quantités d’étain) a été utilisé comme cathode. Des couches séparatrices composées de polyéthylène ou de polypropylène ont été utilisées et l’électrolyte était composé de perchlorate de lithium (LiClO4) dans du carbonate de propylène (PC).
Yoshino a également prouvé la sécurité de cette batterie en 1986 en laissant tomber un poids sur la batterie. Aucun incendie ou explosion ne s’est produit alors que les batteries utilisant une anode en lithium métal ont réagi violemment.

Figure 8. Les premiers tests de sécurité de Yoshino avec sa batterie Li-ion en 1986.
A) Au moment où un morceau de fer entre en collision avec la batterie.
B) Prototype de batterie Li-ion après la collision
C) Batterie à anode Li métallique après collision
[Crédit : Akira Yoshino, The Birth of Li-Ion Battery, Angewandte Essays, Angew., Chem. Int. Ed., 2012, 51, 5798-5800 ]
Ces découvertes et développements ont finalement conduit à la mise sur le marché d’une batterie au lithium commerciale.
en 1991. Grâce à de nouveaux développements, la batterie Li-ion a été commercialisée par Sony en 1991 et par une entreprise commune d’Asahi Kasei et de Toshiba en 1992.
[Nishi, Y., The Development of Lithium Ion Secondary Batteries. Chem. Rec. 2001, 1, 406-413]
La batterie était basée sur un matériau anodique à base de coke de pétrole, LixCoO2 comme cathode, et un électrolyte sans eau composé d’hexafluorophosphate de lithium (LiPF6) dans du carbonate de propylène (PC). La tension de charge était élevée (jusqu’à 4,1 V), avec une énergie spécifique enregistrée de ~80 Wh/kg et une densité énergétique de ~200 Wh/litre.
Comparée aux autres batteries présentes sur le marché à l’époque, la batterie au lithium est rapidement devenue très compétitive et a essentiellement ouvert la voie à la révolution mobile à venir.
À peu près au même moment, on a découvert que le graphite pouvait effectivement être utilisé en combinaison avec une composition d’électrolyte appropriée. [Fong R, Sacken U von, Dahn J. R., Studies of Lithium Intercalation into Carbons Using Nonaqueous Electrochemical Cells. J. Electrochem. Soc. 1990, 137 (7), 2009-2013]
En utilisant des solvants contenant du carbonate d’éthylène, jusqu’à présent généralement négligé en raison de son point de fusion plus élevé, une interphase d’électrolyte solide (SEI) s’est formée à la surface de l’électrode de graphite pendant le cycle de charge/décharge, protégeant ainsi le matériau de carbone de l’exfoliation et de la décomposition ultérieure. [Peled, E. The Electrochemical Behaviour of Alkali and Alkaline Earth Metals in Nonaqueous Battery Systems, The Solid Electrolyte Interphase Model. J. Electrochem. Soc. 1979, 126 (12), 2047-2051.
Cette découverte a été rapidement adoptée par la communauté des fabricants de batteries, et une batterie lithium-ion de nouvelle génération basée sur le graphite comme matériau d’anode a été mise au point. Grâce à ce matériau anodique, des batteries d’une tension de charge de 4,2 V ont été produites peu après, ce qui a permis d’obtenir une densité énergétique de ~400 Wh/litre.
Le développement de la batterie lithium-ion ne s’est pas arrêté avec ces importantes découvertes, mais de nombreuses améliorations et alternatives ont été signalées depuis. Par exemple, de nouveaux matériaux cathodiques sont constamment identifiés pour être utilisés dans des applications spécifiques de batteries, et deux de ces matériaux sont issus du groupe de Goodenough : le matériau spinelle Li1-xMn2O4 et le matériau olivine LixFePO4 (LFP).
[Padhi, A. K. ; Nanjundaswami, K. S. ; Goodenough, J. B. Phospho-Olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries. J. Electrochem. Soc. 1997, 144, 1188-1194.
Thackeray, M. M. ; David, W. I. F. ; Bruce, P. G. ; Goodenough, J. B. Lithium Insertion into Manganese Spinels. Mater. Res. Bull. 1983, 18, 461-472].
Ce dernier matériau est limité par un potentiel par rapport à Li+/Li un peu plus faible que celui de LixCoO2, mais il présente une grande stabilité et peut être utilisé à des taux de charge élevés. Plusieurs autres matériaux d’électrodes et systèmes d’électrolytes ont également été découverts, ce qui a permis d’améliorer sans cesse les matériaux de stockage d’énergie au profit de la société.
Quel type de batterie est utilisé dans les véhicules électriques ?
Aujourd’hui, la plupart des VE utilisent des batteries Li-ion. Auparavant, les batteries Ni-MH et plomb-acide étaient utilisées, mais leur utilisation a lentement diminué en raison de l’arrivée des batteries Li-ion, qui possèdent une énergie spécifique et des valeurs de densité énergétique plus élevées. L’énergie spécifique des batteries au plomb est d’environ 40-50 Wh/kg alors que celle des batteries Li-ion est d’environ 150 Wh/kg. La densité énergétique des batteries plomb-acide est de 80 à 100 Wh/litre, tandis que celle des batteries Li-ion est supérieure à 250 Wh/litre.
Les cellules cylindriques avec des cathodes en nickel-cobalt-aluminium (NCA) et des anodes composites en silicium/graphite, comme celles utilisées dans les derniers packs de batteries Tesla (2019-2020), ont atteint environ 270 Wh/kg et 650 Wh/litre. Une nouvelle technologie appelée Licerion par Sion Power revendique une énergie spécifique de 500 Wh/kg et une densité énergétique de 1000 Wh/L et >450 cycles dans des cellules de développement de 0,4 Ah.
Pour les petites batteries, on parle en termes de Wh. Pour les systèmes de plus grande capacité, l’unité kWh est utilisée. La valeur Wh divisée par 103 donnera le kWh.
Ainsi, 850 Wh = 850/1000 = 0,850 kWh.
Les cellules utilisées dans les batteries des VE d’aujourd’hui peuvent atteindre une énergie spécifique nominale de 140 à 170 Wh/kg. L’énergie spécifique du bloc de batteries résultant est généralement inférieure de 30 à 40 %, soit 80 à 120 Wh/kg. Cette réduction est due à plusieurs fils de connexion en série et en parallèle, au BMS et au système de gestion thermique (refroidissement ou chauffage). En 2019, le pourcentage de packs de composants non cellulaires est descendu à environ 28 %.
Jusqu’à présent, les cellules étaient d’abord mises en modules, puis en packs. Les deux sites Contemporary Amperex Technology Co. Limited, Chine (CATL)et Tesla ont décidé de se débarrasser des modules et de placer les cellules directement dans les packs. CATL l’a déjà fait et l’appelle
la technologie « cell-to-pack
. Bien que les informations à ce sujet soient rares, la société affirme que cela peut augmenter l’énergie spécifique de 10 à 15 % et améliorer l’utilisation du volume de 15 à 20 %. Au total, elle permettrait de réduire de 40 % les pièces nécessaires aux blocs de batteries. [https ://cleantechnica.com/2020/02/18/how-catl-lithium-iron-phosphate-batteries-could-be-leading-to-100-kwh-tesla-model-3/]
Désignation de la batterie au lithium
La Commission électrotechnique internationale (CEI) et l’Indian Standards Institution ont établi une désignation commune pour décrire la chimie et la taille des cellules lithium-ion.
[Piles et batteries au lithium secondaire pour applications portables, Commission électrotechnique internationale, IEC 61960-1 et IEC 61960-2 et IS 16047 : 2012].
Les lettres désignent la chimie et le facteur de forme tandis que les chiffres précisent les dimensions physiques de la cellule. La première lettre décrit la chimie générale, la deuxième lettre désigne la chimie spécifique de la cathode et la troisième lettre désigne la forme.
Première lettre : I – Chimie du lithium-ion
Deuxième lettre : C- cobalt, F- fer, Fp – phosphate de fer, N- nickel, M-manganèse, Mp- phosphate de manganèse, T- titane, V -vanadium et x – autres.
Troisième lettre : R- cylindrique, P-prismatique
Les deux premiers chiffres qui suivent désignent le diamètre en mm et les trois derniers la hauteur en dixièmes de mm. Ainsi, une cellule désignée ICR19/66 est une cellule Lithium ion avec une cathode en cobalt qui a un diamètre qui est > 18 mm et ≤ 19 mm et une hauteur totale maximale qui est > 65 mm et ≤ 66 mm.
Pour les cellules prismatiques, les lettres initiales ont la même signification mais les deux premiers chiffres désignent la largeur en mm, les deux suivants la hauteur en mm et les deux derniers la longueur en mm. Ainsi, la désignation de cellule IMP9/35/150 décrit une cellule prismatique au lithium-ion avec une cellule à cathode de manganèse dont l’épaisseur maximale est de > 8 mm et ≤ 9 mm et une largeur maximale qui est de > 34 mm et ≤ 35 mm et une hauteur totale maximale qui est de > 149 mm et ≤ 150 mm.
Comment fonctionne une batterie au lithium-ion ?
comment est fabriquée une batterie lithium-ion
Le lithium métal, de numéro atomique 3, d’une densité de 0,534 g/cc, ayant un potentiel de réduction standard très faible (couple Li+/Li -3,05 V par rapport à SHE) et une capacité spécifique théorique de 3860 Ah/kg (2061 mAh/cc) est le plus léger, le plus haut voltage et la plus grande densité énergétique de tous les métaux. (A comparer avec le plomb de numéro atomique 82, de densité 11,29 g/cc, de capacité spécifique théorique de 257,8 Ah/kg et de potentiel de réduction standard de -0,35V par rapport à SHE).
Batterie au lithium-ion - Matériaux actifs
Les matériaux actifs de l’électrode positive sont l’un quelconque des oxydes mixtes comme LiCoO2 ou LiMnO2 ou LiFePO4. L’électrode négative est principalement constituée de graphite et de composés de carbone amorphe. Un électrolyte organique (contenant un sel conducteur de lithium dissocié tel que le LIPF6) est utilisé. Un séparateur en polypropylène (PP) ou en polyéthylène (PE) ou mixte est utilisé. Les ions lithium migrent entre les électrodes des batteries lithium-ion pendant la charge et la décharge et sont intercalés dans les matériaux actifs comme décrit ci-dessous :

Figure 9. Vue éclatée d’une cellule lithium-ion
Crédit : Zhang Z., Ramadass P. (2012) Lithium-Ion Battery Systems and Technology. Dans : Meyers R.A. (eds) Encyclopaedia of Sustainability Science and Technology. Springer, New York, NY, pp 6124. http s://doi.org/10.1007/978-1-4419-0851-3_663
Comment se charge une batterie au lithium-ion
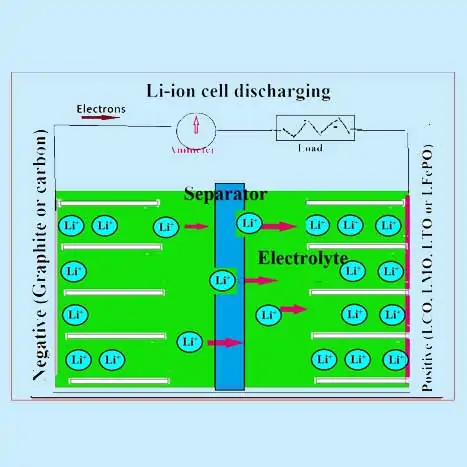
Au cours d’un processus de décharge dans une pile à ions lithium (LIB), les ions lithium de l’anode sont désintercalés (ou extraits) dans l’électrolyte et ces ions lithium de l’électrolyte sont intercalés dans le matériau de la cathode. Ce mouvement des ions de l’anode vers la cathode s’accompagne de la libération d’électrons qui circulent dans le circuit externe. Le processus inverse se produit pendant le processus de charge où les ions de lithium se déplacent de la cathode et s’intercalent dans l’anode à travers l’électrolyte. Les systèmes LIB commerciaux utilisent généralement des oxydes de métaux de transition tels que LiCoO2, LiMn2O4 et LiFePO4 comme matériau de cathode, qui est déposé sur un collecteur de courant en aluminium.
Dix à vingt pour cent de carbone conducteur et 5 à 10 % de liants polymères comme le difluorure de polyvinylidène (PVDF) et le polytétrafluoroéthylène (PTFE) sont également ajoutés à la matière active pour améliorer la conductivité électronique et obtenir une meilleure adhérence de la matière de l’électrode, respectivement. Le matériau anodique est recouvert d’un collecteur de courant en cuivre avec du carbone conducteur et du PVDF si nécessaire.
Les deux électrodes sont séparées par un séparateur poreux (film de polyéthylène ou de polypropylène d’une épaisseur de 10-20 µm) trempé dans une solution d’électrolyte (LiPF6 dans un solvant organique). Le séparateur et la solution d’électrolyte doivent avoir une meilleure conductivité ionique. La cellule est généralement fabriquée dans un boîtier métallique en forme de rouleau avec un séparateur immergé dans l’électrolyte entre les deux électrodes. Le schéma d’une batterie LIB est présenté dans les figures, où sont illustrés les processus typiques de charge et de décharge.
Les batteries rechargeables lithium-ion (Li-ion) utilisent une insertion/extraction réversible d’ions lithium (Li+) (espèces invitées) dans ou à partir d’une matrice hôte (matériaux actifs d’électrode positive et négative) appelée composés d’insertion de lithium lors des processus de décharge et de charge. Les batteries aux ions de lithium ont été appelées batteries à bascule, car les ions de lithium « oscillent » entre les électrodes positives et négatives lorsque la cellule est chargée et déchargée.
Le matériau actif positif est généralement un oxyde métallique à structure stratifiée, tel que l’oxyde de lithium et de cobalt (LiCoO2), ou un matériau présentant une structure à effet tunnel, tel que l’oxyde de lithium et de manganèse (LiMn2O4), le plus souvent sur un collecteur de courant en aluminium. Le matériau actif négatif est généralement un carbone graphitique, également un matériau en couches, le plus souvent sur un collecteur de courant en cuivre. Dans le processus de charge-décharge, les ions lithium sont insérés ou extraits de l’espace interstitiel entre les couches atomiques des matériaux actifs.
Les électrolytes non aqueux ou les électrolytes organiques sont utilisés dans les piles au lithium.
Les séparateurs pour les batteries lithium-ion sont des films microporeux en polyoléfine : polyéthylène (PE) et polypropylène (PP).

Réactions électrochimiques dans une batterie au lithium-ion
Dans une cellule lithium-ion typique, les réactions génériques suivantes se produisent.
Réaction de l’électrode positive :
LiMO2 ⇔ Li1-xMO2 + x Li+ + x e-
Réaction de l’électrode négative :
C + y Li+ + ye- ⇔ LiyC
Réaction cellulaire totale :
LiMO2 + x/y C ⇔ x/y LiyC + Li1-xMO2
M = métaux tels que Co, Mn, Ni, Ti, etc.
Normalement, x est environ 0,5 et y est environ 0,16, donc x/y est environ 3.. [Jeff Dahn et Grant M. Ehrlich. « Lithium ion batteries », Linden’s Handbook of Batteries,4ème édition, Thomas B. Reddy (Ed.), McGraw
Electrolyte et interphase solide-électrolyte (SEI)
Comme mentionné précédemment, des électrolytes non aqueux ou des électrolytes organiques sont utilisés dans les piles au lithium. Les cellules Li-I fonctionnent à des tensions comparativement plus élevées, jusqu’à 4,2 V par cellule. Bien que les sels de lithium volumineux tels que l’hexafluorophosphate de lithium (LiPF6), l’hexafluoroarsenate de lithium (LiAsF6), le tétrafluoroborate de lithium (LiBF4), le perchlorate de lithium (LiClO4), le trifluorométhanesulfonate de lithium (LiCF3SO3), le difluoro(oxalate)borate de lithium (LIODFB), etc. sont les véritables électrolytes (sels d’électrolyte de maintien), ils nécessitent des solvants appropriés et stables à une tension aussi élevée. La plupart de ces solvants ont des constantes diélectriques élevées, facilitant la dissociation ionique et l’existence d’ions Li- très concentrés. Ces solvants servent également de gaines de solvatation pour l’existence stable des ions Li, diminuant ainsi l’influence des contre-anions.
L’inconvénient des constantes diélectriques élevées est qu’elles ont des valeurs de viscosité plus élevées, ce qui entraîne une mobilité réduite des ions. Pour surmonter la faible conductivité ionique, les solvants peu visqueux sont généralement mélangés à des solvants très visqueux. Mais, comme les solvants peu visqueux ont une dissociation ionique plus faible, il devient impératif de trouver un rapport de mélange optimal pour que le mélange ait à la fois une bonne conductivité ionique et une bonne mobilité. Comme solvants non aqueux, des mélanges de carbonate d’éthylène (EC) avec des carbonates d’alkyle linéaires moins visqueux tels que le carbonate de diméthyle (DMC), le carbonate de diéthyle (DEC) et le carbonate d’éthylméthyle (EMC) sont utilisés dans les LIB disponibles dans le commerce.
Les solvants aprotiques sont les éthers, les esters et les carbonates d’alkyle : Ce sont l’éther diéthylique (DEE), le tétrahydrofurane (THF), le dioxolane, le carbonate d’éthylène (EC), le carbonate de propylène (PC), le carbonate de diméthyle (DMC), le carbonate de diéthyle (DEC), carbonate de diéthyle (DEC), carbonate de diéthyle (DEC), carbonate de méthyle (EMC), formiate de méthyle, γ-butyrolactone (BL), acétate de méthyle, acétonitrile (AN), diméthylsulfoxyde (DMSO), diméthylformamide (DMF), chlorure de méthyle, nitrométhane, etc.)
Les électrolytes liquides sont des solutions d’un sel de lithium dans un ou plusieurs solvants organiques, généralement des carbonates.
Le carbonate de propylène (PC) ne peut pas être utilisé comme électrolyte si le graphite doit être utilisé comme anode, car il se décompose à la surface du graphite ; le PC utilisé seul, sans CE ou de petites additions de LiBOB (Li bisoxalato borate), peut provoquer une dégradation des électrodes en graphite car il co-intercède avec le lithium, ce qui entraîne une exfoliation.
L’électrolyte est invariant (le même nombre d’ions entre et sort de l’électrolyte pendant la charge et la décharge).
décharge). Le sel électrolyte est généralement dissous dans des solvants organiques carbonatés. Chaque fabricant propose une combinaison différente de solvants, le carbonate d’éthylène (CE) étant le dénominateur commun de la plupart des fabricants.
La formation de la couche d’interphase solide-électrolyte (SEI) est une autre fonction importante assurée par les électrolytes. Lorsqu’un métal alcalin est immergé dans l’électrolyte d’une batterie, ou lorsqu’un potentiel négatif est appliqué à un carbone ou à une électrode inerte immergée dans l’électrolyte, un SEI commence à se former.
La couche SEI qui se forme instantanément au contact du métal avec la solution, est constituée de produits de réduction insolubles et partiellement solubles des composants de l’électrolyte. Le SEI est le facteur clé qui détermine la sécurité, la capacité de puissance, la morphologie des dépôts de lithium, la durée de conservation et la durée de vie de la batterie. Une bonne adhésion à l’anode est également importante.
Comme nous l’avons souligné ci-dessus, il n’est possible de construire des batteries primaires ou secondaires alcalines ou alcalino-terreuses pratiques que si la dissolution ou la corrosion de l’anode peut être arrêtée. L’électrolyte doit donc être conçu pour contenir au moins un précurseur de SEI qui réagit rapidement avec le lithium (ou avec l’anode en métal alcalin) pour former une interphase solide-électrolyte insoluble. Les produits de la réduction des anions de sel sont généralement des composés inorganiques comme LiF, LiCl et Li2O, qui précipitent sur la surface de l’électrode. La réduction du solvant est suivie par la formation de composants SEI insolubles comme le Li2CO3 et de semi-carbonates et polymères partiellement solubles.
Dans le cas de l’électrode de carbone, la tension à laquelle se forme la SEI dépend du type de carbone, des propriétés catalytiques de sa surface (teneur en cendres, type de plan cristallographique, rapport entre le plan de base et le plan de bord), de la température, de la concentration et des types de solvants, de sels et d’impuretés, ainsi que de la densité de courant. Lors de la première charge d’une batterie lithium-ion, il y a une perte de capacité appelée » perte de capacité irréversible » (QIR) principalement nécessaire à la formation du SEI.
En plus de la formation du SEI, le QIR peut être causé par une perte de capacité associée à la formation de produits de réduction solubles (PSQ).
Un SEI exempt de toute contamination est essentiel pour la longue durée de vie de la batterie. Elle devient encore plus importante lors de cycles à des taux élevés et à une plus grande profondeur de décharge.
Les SEI dans les solutions d’hexafluorophosphate de lithium (LiPF6) et d’hexafluoroarséniate de lithium (LiAsF6) ont une résistivité plus élevée que les solutions d’autres sels. Ceci est dû aux changements de résistivité qui contribuent à la résistance contrôlée par les espèces, ce qui conduit à l’impédance interfaciale élevée de l’anode de lithium dans les électrolytes LiPF6 et LiAsF6. En outre, Li2CO3 est déclaré être l’un des meilleurs agents passivants pour l’amélioration de l’efficacité du recyclage du lithium [J Electrochem Soc.,164 (7) A1703-A1719 (2017)].
Séparateurs pour les batteries lithium-ion
Les séparateurs pour les batteries lithium-ion sont des films microporeux en polyoléfine et sont généralement du polyéthylène (PE) et du polypropylène (PP) étirés uniaxialement, du PE étiré biaxialement ou du PP/PE/PP étiré multiaxialement.
Matières premières pour les matériaux actifs de la batterie lithium-ion
Les batteries lithium-ion utilisent différents matériaux de cathode. L’anode est invariablement à base de carbone, à l’exception de quelques anodes en oxyde de titane-niobium, en alliage Li-Si, etc. Le tableau et la figure suivants donnent une idée des différentes chimies employées dans ces batteries.

Figure 12. Un résumé de certaines options actuelles et futures en matière de chimie des électrodes pour les batteries au lithium-ion. La capacité proposée pour le Li(Si) est de 50 % de la capacité théorique du matériau, comme c’est le cas pour certains matériaux d’électrode positive.
[Crédit : Yu Miao, Patrick Hynan, Annette von Jouanne et Alexandre Yokochi, Énergies 2019, 12, 1074 ; doi:10.3390/en12061074].
Tableau 1.
Caractéristiques des cellules lithium-ion avec différents matériaux de cathode
| Matériau de la cathode | Li-Ni-Co-Al (NCA) | Li-Ni-Mn-Co (NMC) | Li-MnO2 (LMO) | Phosphate de Li-Iron (LFP) | Titanate de Li (LTO) | Oxyde de Cobalt Li (LCO) |
|---|---|---|---|---|---|---|
| Tension nominale d'une cellule (V) | 3.6 | 3.65 (2.7-4.2) | 3.8 | 3.25 (2-3.6) | 3.2 | 3.6 |
| Énergie spécifique théorique (Wh/kg) | 279 | 256 | 148 | 128 (373) | 293 (175) | 274 (370) (x=0.5) |
| Capacité spécifique des cathodes (Ah/Kg) Potentiel vs Li/Li+ (V) | 180-200 (3.8) | 200 | 148 (4.1) | 150-170 (3.45) | 175 | 274 (3.9) (x=0.5) |
| Énergie spécifique des cathodes (Wh/Kg) | 680-760 | 610-680 | 410-492 548 | 518-587 544 | -- | 546 |
| Sécurité | sûr | Modéré | Sécurité | Haut | Très bien | Modéré |
Matériaux de cathode dans les batteries lithium-ion
Les matériaux de la cathode doivent répondre à plusieurs exigences dont dépend le choix du matériau de l’électrode positive.
- Pour offrir une capacité élevée, ces matériaux doivent incorporer une grande quantité de lithium dans leur fabrication.
- En outre, les matériaux doivent s’intercaler de manière réversible avec peu de changements structurels pour permettre une longue durée de vie, un rendement ampère-heure élevé et un rendement énergétique élevé.
- Pour obtenir une tension de cellule élevée et une densité d’énergie élevée, la réaction d’échange de lithium doit se produire à un potentiel élevé par rapport au lithium.
- Pour faciliter les processus de charge et de décharge à haut débit, la conductivité électronique et la mobilité des ions lithium dans le matériau doivent être élevées.
- Le matériau de l’électrode positive ne doit pas se dissoudre dans l’électrolyte et doit être disponible à un coût abordable. Pour minimiser les coûts, la préparation à partir de matériaux peu coûteux dans un processus à faible coût est préférable.
Le LiFePO4 est une exception à cette règle. Dans le LiFePO4, le transport adéquat des ions lithium est obtenu par l’utilisation de particules d’électrode ayant une taille de particule nanométrique. [Jeff Dahn et Grant M. Ehrlich. « Lithium ion batteries », Linden’s Handbook of Batteries,4e édition, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26.6, 2011].
Les matériaux actifs positifs (PAM) des cellules lithium-ion varient en fonction du fabricant. Les matériaux cathodiques peuvent être classés en trois grandes catégories [Arumugam Manthiram, Nature Communications (2020) 11:1550]. Il s’agit de :
Oxydes stratifiés - matériaux cathodiques dans les batteries au lithium-ion
Plusieurs oxydes de type général LiMO2 (où M =vanadium, chrome, cobalt et nickel) cristallisent dans une structure en couches dans laquelle les ions Li+ et M3+ occupent les voies alternées de la structure du sel gemme pour donner une séquence de couches de O-Li-O-M-O.
Dans la cathode d’oxyde stratifié LiCoO2, les grandes différences de charge et de taille entre les ions Li+ et Co3+ trivalents conduisent à un bon ordonnancement des cations, ce qui est essentiel pour soutenir la diffusion rapide bidimensionnelle des ions lithium et la conductivité dans le plan du lithium.
Les matériaux de cathode exigent des niveaux de pureté extrêmement élevés et doivent être presque entièrement exempts d’impuretés métalliques indésirables, notamment le fer, le vanadium et le soufre.

Figure 13. Schéma simplifié d’une structure en couches dans laquelle il y a une occupation alternée du
entre les couches d’ions d’oxyde très rapprochées.
[Crédit : Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.168].
La bonne stabilité structurelle ainsi que la conductivité électrique et lithium-ion élevée offrent des caractéristiques de charge-décharge rapides avec une bonne réversibilité. Grâce à ces caractéristiques, LiCoO2 reste l’une des meilleures cathodes à ce jour avec une tension de fonctionnement élevée de ~4 V. La cathode LiCoO2 a résolu
deux défis majeurs associés aux cathodes de sulfure poursuivies dans les années 1970. Il a permis non seulement une augmentation substantielle de la tension de fonctionnement de <2,5 V à ~4 V mais aussi l’assemblage d’une cellule sans avoir besoin d’employer une anode en lithium métallique.
Les oxydes spinelles - matériaux cathodiques dans les batteries au lithium-ion
La deuxième catégorie de cathode est le spinelle LiMn2O4. (La formule générale est AB2O4). Bien que cette structure soit généralement représentée en coordonnées cubiques, elle comporte également des couches parallèles d’ions d’oxyde sur les plans (111), et il existe des sites à coordination octaédrique et des sites à coordination tétraédrique entre les plans d’ions d’oxyde. Le nombre de sites octaédriques est égal au nombre d’ions oxyde, mais il y a deux fois plus de sites tétraédriques. La stabilité structurelle tridimensionnelle et la conductivité électrique et lithium-ion élevée offrent des caractéristiques de charge-décharge encore plus rapides pour Li1-xMn2O4 avec une bonne réversibilité par rapport à LiCoO2.
Un avantage important du passage du LiCoO2 au LiMn2O4 est la réduction significative du coût, le manganèse étant deux ordres de grandeur plus bas que le Co. Cependant, un problème critique avec le LiMn2O4 est la dissolution du manganèse du réseau dans l’électrolyte en présence de traces (niveaux ppm) d’ions H+ (acidité) dans l’électrolyte en raison des disproportions bien connues de Mn3+ en Mn4+ et Mn2+ dans l’acide.

Figure 14 . Schéma de la structure spinelle dans laquelle les cations sont répartis entre les plans (111) serrés des ions oxyde parmi les sites tétraédriques et octaédriques [Crédit : Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.17].
Le matériau cathodique haute tension Lithium-Nickel-Oxide de manganèse (LNMO) semble prometteur pour les batteries de la prochaine génération. Mais la pierre d’achoppement est l’absence d’un électrolyte capable de supporter les contraintes d’une batterie à base de LNMO. Les cellules de batterie à cathode LNMO offrent des résultats comparables à ceux des autres batteries au lithium à haute performance, mais à un coût considérablement inférieur.
Cependant, les fabricants d’électrolytes obtiennent des résultats très prometteurs grâce à la recherche et au développement en cours qui, à un moment donné, aboutiront à des électrolytes qui fonctionneront bien dans une cellule de batterie LNMO. https ://blog.topsoe.com/the-cathode-material-for-next-generation-lithium-ion-batteries-is-ready (en anglais)
Plus récemment, l’augmentation de la teneur en Ni et la diminution ou l’élimination de la teneur en cobalt dans les cathodes NMC sont devenues beaucoup plus importantes [Li, W., Erickson., E. & Manthiram, A. High-nickel layered oxide cathodes for lithium-based automotive batteries, Nat. Energy 5, 26-24(2020)].
Oxydes de poly-anions - matériaux cathodiques dans les batteries au lithium-ion
La troisième classe d’oxydes est celle des oxydes de polyanions. Les oxydes de polyanions comme Fe2(MoO4)3 et Fe2(WO4)3 subissent une insertion/extraction réversible de deux ions lithium par unité de formule pour donner Li2Fe2(MoO4)3 ou Li2Fe2(WO4)3 par des méthodes chimiques et électrochimiques.
[Manthiram, A., Goodenough, J. B. Lithium insertion into Fe2(MO4)3 frameworks : comparison of M = W with M = Mo. J. Solid State Chem. 71, 349–360 (1987)].
Basé sur les travaux de Manthiram et Goodenough,
[Manthiram, A. & Goodenough, J. B. Lithium insertion into Fe2(MO4)3 frameworks : comparison of M = W with M = Mo. J. Solid State Chem. 71, 349-360 (1987). Manthiram, A. & Goodenough, J. B. Lithium insertion into Fe2(SO4)3 framework. J. Power Sources 26, 403-406 (1989)].
L’exploration des phosphates contenant du lithium comme cathodes a conduit à l’identification de l’olivine LiFePO4 comme cathode [Padhi, A. K., Nanjundaswamy, K. S. & Goodenough, J. B. Phospho-Olivines as positive electrode materials for rechargeable lithium batteries. J. Electrochem. Soc. 144, 1188-1194 (1997)] en 1997.
Mais, la classe des oxydes de polyanions souffre d’une mauvaise conductivité électronique.[Arumugam Manthiram, Nature Communications (2020) 11:1550].
L’exploration des phosphates contenant du lithium comme cathodes a conduit à l’identification de l’olivine LiFePO4 comme cathode [Padhi, A. K., Nanjundaswamy, K. S. & Goodenough, J. B. Phospho-Olivines as positive electrode materials for rechargeable lithium batteries. J. Electrochem. Soc. 144, 1188-1194 (1997)] en 1997.
Mais, la classe des oxydes de polyanions souffre d’une mauvaise conductivité électronique.[Arumugam Manthiram, Nature Communications (2020) 11:1550].
Fabrication de matériaux cathodiques - Batterie lithium-ion
Auparavant, les composés cathodiques à base d’oxyde de lithium et de métal étaient fabriqués à partir de carbonate de lithium et d’un sel du métal choisi au moyen d’une série de réactions de remplacement chimique réalisées en solution. Le produit souhaité est précipité et séché par pulvérisation.
LiCoO2 a d’abord été préparé par la méthode de synthèse conventionnelle indiquée sur la figure. Le tétraoxyde de tricobalt (Co304) et le carbonate de lithium (Li2CO3) ont été bien mélangés, suivi d’une calcination dans le flux d’air à une température d’environ 950ºC. Avec cette méthode, il était toutefois très difficile de préparer des particules grossières de LiCoO2 et seules des particules fines d’un diamètre de 1 à 3 pm pouvaient être obtenues.
Les matériaux fins des électrodes actives ne sont pas souhaitables du point de vue de la sécurité. Dans le cas d’abus tels qu’un court-circuit externe ou un écrasement, les fines particules à grande surface spécifique réagissent facilement en une seule fois et toute l’énergie de la cellule est brusquement libérée en un temps très court, avec l’élévation de température qui l’accompagne. Dans le pire des cas, la pile peut prendre feu [Yoshio Nishi, in Lithium ion Batteries, M. Wakihara et 0. Yamamoto (Eds.). page 192-193].
Comment la batterie lithium-ion est-elle fabriquée ? organigramme
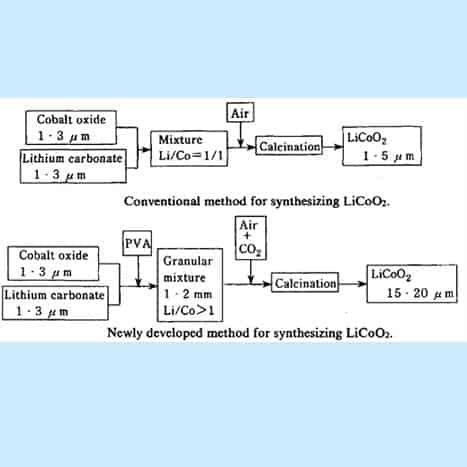
Figure 15. Organigramme pour la fabrication de Li-CoO2
[Crédit : Yoshio Nishi, in Lithium ion Batteries, M. Wakihara et 0. Yamamoto (Eds.). page 192-193].
Un procédé amélioré pour synthétiser du cobaltite de lithium de plus grande taille de particule : Le premier point est qu’une petite quantité de résine PVA est ajoutée dans les mélanges de matières premières (Co304 et Li2CO3)) pour former des pastilles granulaires avec un granulateur. En frittant les pastilles dans un flux d’air contenant une quantité appropriée de gaz C02, des particules de cobaltite de lithium d’un diamètre moyen de 20pm sont synthétisées. Le deuxième point est que nous utilisons une quantité légèrement excessive de carbonate de lithium (Li2CO3) dans les matières premières, de sorte que le rapport atomique Li/Co dans les matières premières est supérieur à un. Cette procédure est également favorable à l’obtention de particules grossières, et en outre, le LiCoO2 obtenu contient une petite quantité de Li2CO3 résiduel.
Le premier point est qu’une petite quantité de résine PVA est ajoutée aux mélanges de matières premières (Co304 et Li2CO3) pour former des granulés avec un granulateur. Par frittage L’oxyde de lithium et de cobalt peut être facilement préparé par la cuisson à haute température d’un mélange stœchiométrique de carbonate de lithium Li2CO3 et d’oxyde de cobalt, Co3O4 ou de cobalt métallique à 600-800°C, puis par le recuit du produit à 900°C pendant de nombreuses heures, le tout sous atmosphère d’oxygène.
Il peut également être obtenu par calcination de l’oxyde hydraté avec de l’hydroxyde de lithium jusqu’à 750-900°C.
Une troisième méthode utilise l’acétate de lithium, l’acétate de cobalt et l’acide citrique en quantités molaires égales, en solution aqueuse. Un chauffage à 80°C transforme le mélange en un gel transparent et visqueux. Le gel séché est ensuite broyé et chauffé progressivement à 550°C. (https : //en.wikipedia.org/wiki/Lithium_cobalt_oxide).
Voici quelques exemples typiques : La méthode sol-gel
Dans un procédé sol-gel, les solutions aqueuses des réactifs et une solution d’agent chélateur sont mélangées. Une évaporation lente du solvant génère un sol et un chauffage modéré du sol ainsi obtenu produit un gel. Ce dernier est calciné à une température appropriée pour obtenir le produit souhaité.
Exemple 1.
Synthèse de LiCoO2 à partir de différents agents complexants : Les sels utilisés étaient le nitrate de cobalt hexa hydrate (Co(NO3)2.6H2O, et le nitrate de lithium, anhydre LiNO3. Le gel a été produit en utilisant quatre agents complexants différents : acide citrique, anhydre (C3H4OH(COOH)3, glycine, (H2NCH2COOH) ; amidon (amidon de maïs commercial et gélatine).
Cinq solutions contenant LiNO3 et Co(NO3)2.6H2O dans 20 ml d’eau, avec une proportion de Li:Co = 1,1:1 sont préparées. Un agent complexant spécifique est ajouté à chaque solution :(i) acide citrique (4,611 g) dilué dans 5 ml d’eau ;(ii) glycine (1,501 g) ;(iii) amidon (1,250 g) ;(iv) gélatine (3,500 g) et(v) essai à blanc.
Les quatre premières solutions ont été chauffées à une température de 70 à 80°C dans un bain de glycérine jusqu’à la formation du gel. La durée de ce processus est différente pour chaque agent gélifiant :(i) acide citrique (5 heures),(ii) glycine (3 heures),(iii) amidon (1 heure),(iv) gélatine (3 heures). La production de poudres cristallines pour tous les échantillons a été réalisée en deux étapes dans un four à moufle : d’abord avec la cuisson des matériaux à 300°C pendant 20-30 minutes et ensuite le chauffage à 700°C pendant 24 heures. [Bruno G. A. Freitas et autres, J. Braz. Chem. Soc. 28, 11, Nov. 2017].
Exemple 2.
Préparé par une méthode Sol-Gel
Le LiNO3 est d’abord dissous dans une solution d’acide citrique. LiNO3, Ni(NO3)2.6H2O Co(Ac)2.4H2O et Mg(NO3)2.6H2O ont été utilisés comme matériaux de départ du lithium, du nickel, du cobalt et du magnésium dans LiNi0.7-𝑥M𝑥Co0.3O2(0 ⩽ 𝑥 ⩽ 0,1), respectivement. La quantité d’acide citrique est égale à la quantité molaire totale de Co, Ni et Mg. Ensuite, Co(Ac)2 4H2O, Ni(NO3)2 6H2O et Mg(NO3)2 6H2O ont été ajoutés au mélange. L’ensemble du mélange a été chauffé au bain-marie à 80∘C. Pendant le processus de chauffage, une solution claire et rose sans aucune précipitation s’est formée. Enfin, la solution claire a été lentement séchée et transformée en gel. Le xérogel a été séché, broyé, puis traité thermiquement dans un four à 120°C pendant 12h.
Le précurseur de gel a été calciné à 500°C dans l’air pendant 6 heures, puis refroidi à température ambiante dans un four tubulaire. Les produits traités thermiquement ont été broyés dans un mortier en agate pour obtenir des poudres. Puis la poudre a été calcinée à 800°C pendant 12 heures. Pour la fabrication des cathodes, les produits préparés ont d’abord été mélangés avec du noir d’acétylène et du fluorure de polyvinylidène (80 : 8 : 12 en poids) dans de la 𝑁-méthyl pyrrolidone (NMP). La bouillie obtenue a ensuite été appliquée sur une feuille d’aluminium et séchée à 80oC pendant 18 heures pour être ensuite pressée au rouleau. . [Hailang Zhang, Advances in Materials Science and Engineering Vol 2014, Article ID 746341,]

Figure 16. Organigramme du procédé sol-gel pour la préparation du manganate de lithium
(Crédit : Y.S. Lee, Y.K. Sun et K.S. Nahm, Solid State Ionics 109 (1998) 285 comme indiqué par M. Pasquali, S. Passerini et G Pistoia.dans Lithium Batteries, Science and Technology, ed. par G. A. Nazri et G. Pistoia, Springer, New York, (2009), p. 318)
Fabrication de matériaux d'anode dans les batteries au lithium-ion
La voie encourageante menant aux technologies LIB avec une densité d’énergie et de puissance améliorée est la sélection de matériaux anodiques appropriés qui peuvent fournir une capacité élevée et une diffusion facile des ions Li-ion dans l’anode, avec une bonne durée de vie et sans problèmes de sécurité.
En fonction des matériaux précurseurs, les anodes en carbone peuvent être classées en plusieurs types, comme indiqué ci-dessous.
Le matériau précurseur et les paramètres de traitement déterminent la nature du carbone produit. Les matériaux qui peuvent être graphitisés par traitement à haute température (2000 à 3000°C) sont appelés
carbones mous
.
Lors de la graphitisation, le désordre turbostratique est éliminé progressivement avec l’augmentation de la température, et la déformation du matériau est réduite [T. Zheng, J. N. Reimers, et J. R. Dahn, Physique. Rev. B 51, 734 (1995)]
Carbones durs
tels que ceux préparés à partir de résine phénolique, ne peuvent pas être facilement graphitisés, même lorsqu’ils sont traités à 3000°C. Les matériaux de type coke sont préparés à environ 1000°C, généralement à partir d’un précurseur pétrolier aromatique [Jeff Dahn et Grant M. Ehrlich. « Lithium ion batteries », Linden’s Handbook of Batteries,4e édition, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26, 2011.]

Figure 17. Classification des précurseurs de matériaux d’anode en carbone
[Crédit : Jeff Dahn et Grant M. Ehrlich. « Lithium ion batteries », Linden’s Handbook of Batteries,4e édition, Thomas B. Reddy (Ed.), McGraw Hill, pp. 26, 2011.]
Goriparti divise les matériaux d’anode du LIB en
trois catégories
en fonction de leur mécanisme de réaction avec le lithium [Subrahmanyam Goriparti, Ermanno Miele, Francesco De Angelis, Enzo Di Fabrizio, Remo Proietti Zaccaria, Claudio Capiglia, J Power Sources 257 (2014) 421-443].
Le groupe d'intercalation/désintercalation
Cette catégorie d’anodes comprend les matériaux carbonés et les oxydes de titane. La capacité de stockage qui se produit par le biais d’une voie d’intercalation est étroitement associée à l’aire de surface, à la morphologie, à la cristallinité et à son orientation. Les carbones mous sont généralement bien acceptés et utilisés dans l’industrie des batteries. Il a été constaté que le carbone mou est une technologie assez mature, tandis que le carbone dur peut présenter une solution alternative intéressante, notamment pour les applications nécessitant une capacité élevée, comme dans le secteur des véhicules électriques. Les anodes d’oxyde de titane sont déjà utilisées par certaines industries de batteries.


Le graphène a également fait l’objet d’un examen approfondi. En particulier, on a vu que leurs propriétés électriques rendent ce matériau particulièrement adapté aux anodes hybrides graphène/métal (par exemple graphène avec SnO2 et Fe2O3). Les nanotubes de carbone (NTC) ont été choisis pour leurs résultats académiques très intéressants, bien que le coût de production puisse entraver leur application comme matériau actif d’anode dans l’industrie des batteries à l’avenir.


Cependant, pour les grandes batteries des VE, les graphites à faible coût sont normalement préférés pour des raisons de coût.
Dans une deuxième catégorie, les matériaux d’alliage tels que Si, Ge, SiO, SnO2 ont été décrits. Ces matériaux peuvent fournir des capacités plus importantes et une densité énergétique élevée par rapport au groupe précédent, en réagissant avec le lithium dans un mécanisme électrochimique d’alliage/désalliage. Toutefois, ce processus implique une forte expansion du volume, ce qui entraîne une perte de capacité substantielle lors du cyclage. La réduction des dimensions à l’échelle nanométrique, ainsi que la réalisation de structures complexes par la combinaison avec des matrices conductrices, ont été proposées pour surmonter les problèmes susmentionnés et améliorer les performances globales des anodes.
Le silicium et le SnO2, ainsi que leur composite avec le carbone, sont les matériaux les plus prometteurs pour des applications dans les futures batteries au lithium. Cependant, une méthode peu coûteuse pour leur production de masse comme matériaux d’anode est encore nécessaire. En revanche, le Ge, bien qu’intéressant pour ses propriétés électrochimiques et ses excellents résultats expérimentaux en laboratoire, présente l’inconvénient d’être le cinquantième élément en termes d’abondance dans la croûte terrestre. Par conséquent, elle ne semble pas être une bonne option pour l’application de masse de la technologie des batteries au lithium.
Dans le troisième groupe, des matériaux réagissant avec le lithium selon une réaction de conversion ont été décrits. En particulier, les oxydes métalliques/phosphures/nitrures/sulfures ont été considérés. Cependant, ces matériaux sont encore loin du grand marché commercial des batteries au lithium, en raison d’une faible rétention de capacité et d’une grande hystérésis potentielle. Par conséquent, diverses formes nanostructurées de ces matériaux ont également été étudiées pour résoudre les problèmes susmentionnés.
La nanotechnologie est assurément une approche formidable pour concevoir la prochaine génération de matériaux d’anode pour les batteries au lithium. Afin d’utiliser les matériaux décrits comme anodes efficaces dans les batteries LIB commerciales, en particulier pour les applications EV, des travaux de recherche supplémentaires sont cependant nécessaires. En fait, il est nécessaire d’obtenir à la fois une énergie et une densité de puissance plus élevées et de mettre au point des procédés de fabrication peu coûteux pour la synthèse à grande échelle de matériaux de taille nanométrique. En outre, l’étude des mécanismes régissant l’interaction entre le lithium et les formes nanométriques des matériaux décrits, ainsi que les propriétés de transport d’électrons à l’interface électrode/électrolyte, est d’une importance cruciale pour la conception de la prochaine génération de matériaux actifs d’anode issus de la nanotechnologie.
Les électrodes négatives actuellement utilisées dans les piles au lithium impliquent une solution solide de lithium dans l’une des formes de carbone. Les piles au lithium qui fonctionnent à des températures supérieures au point de fusion du lithium doivent nécessairement utiliser des alliages au lieu du lithium élémentaire. Il s’agit généralement de phases métalliques binaires ou ternaires. On s’intéresse également de plus en plus à la possibilité d’utiliser des alliages métalliques à la place des carbones à des températures ambiantes, dans le but de réduire le volume de l’électrode et d’obtenir une capacité nettement supérieure. [Robert A. Huggins, Advanced Batteries, Materials Science Aspects, Springer, New York, 2009, p.123].
Le graphite est amphotère, et des cations ou des anions peuvent y être insérés entre les couches de graphène. Lorsque des cations sont insérés, la structure du graphite hôte prend une charge négative. Les exemples de cations sont Li+, K+, Rb+ et Cs+. Lorsque des anions sont insérés, la structure du graphite hôte prend une charge positive, et les exemples d’anions sont Br
–
SO2-, SbF6-, etc.
L’insertion de métaux alcalins dans le carbone a été démontrée pour la première fois en 1926 [ K. Fredenhagen et G. Cadenbach, Z. Anorg. Allg. Chem. 158, 249 (1926)] et la synthèse chimique des carbones de lithium a été démontrée en 1955. [D. Guerard, A. Herold, Carbon 13, 337 (1975)]. Rayon X des expériences de spectroscopie de photoémission ont montré que le lithium inséré cède son électron au carbone, et que la structure peut donc être considérée comme des ions Li+ contenus entre les couches de carbone de la structure graphite.
[G.K. Wertheim, P.M.Th.M. Van Attekum et S. Basu, Solid State Commun. 33, 1127 (1980)]. Une revue générale des premiers travaux sur l’insertion d’espèces dans le graphite peut être trouvée dans
[L.B. Ebert, Intercalation Compounds of Graphite, in Annual Review of Materials Science,
Vol. 6, éd. par R.A. Huggins, Annual Reviews, Palo Alto, CA (1976), p. 181].
Le facteur important de la pureté du matériau de l’anode est la nécessité d’éliminer toute espèce contenant de l’oxygène à la surface, car celle-ci réagirait avec l’électrolyte. Pour éviter cette réaction, les fabricants cuisent le graphite à 1100ºC) dans des atmosphères réductrices ou inertes. Cela augmente le coût pour d’autres utilisations, par rapport au graphite. Le carbone (90%) est mélangé à plusieurs autres ingrédients pour former la pâte ou la boue d’anode. Comme pour la cathode, le polyfluorure de vinylidène (PVDF) est utilisé comme liant (-5%), et une petite quantité de noir de carbone est ajoutée pour assurer la conductivité. En outre, la n-méthyl pyrrolidone (NMP) est utilisée pour solubiliser les matériaux afin de former un mélange uniforme. La pression assure une taille de grain uniforme (Sandi 1999).
Le titanate de lithium (LTO) suscite beaucoup d’intérêt. Les cellules LTO fonctionnent à une température inférieure à celle des autres produits chimiques et offrent une densité de puissance élevée. Toutefois, ces cellules souffrent d’une tension nominale plus faible, de l’ordre de 2,2 à 2,3 V par cellule. [Norio Takami, Hiroki Inagaki, Yoshinao Tatebayashi, Hidesato Saruwatari, Keizoh Honda, Shun Egusa, J Power Sources 244 (2013) 469-475].
Le matériau de l’électrode, généralement du graphite, se dilate de 10 % pendant le processus de charge. Le graphite retrouve son volume initial lorsque les ions lithium se désintercalent. Les ions de lithium seraient non seulement intercalés dans le graphite si l’on utilise de l’aluminium, mais également insérés dans le conducteur, formant ainsi un alliage aluminium-lithium. Le processus inverse se produirait lors de la décharge. L’aluminium serait dégradé après quelques cycles et serait inutile comme collecteur de courant.
Toutefois, si l’électrode négative est constituée de titanate de lithium au lieu de graphite, la situation change radicalement. Le potentiel d’électrode du Li4Ti5O12 est environ 1,4 V plus élevé que celui du graphite (la tension de cellule est environ 1,4 V plus basse, 2,2 V contre 3,6 V). Cela empêcherait les ions de lithium d’être intercalés dans l’aluminium. L’aluminium est donc préféré au cuivre pour des raisons de coût et de poids. Le Li4Ti5O12 est principalement employé dans des applications stationnaires en raison de sa tension de cellule plus faible.[Călin Wurm et al, in Lithium-Ion Batteries, Reiner Korthauer (ed), Traduit par Michael Wuest et.al, Springer, 2018. pp. 57].
Procédé de production de titanate de lithium : Un mélange de dioxyde de titane et d’un composé du lithium (l’un quelconque de ceux-ci : carbonate de lithium, hydroxyde de lithium, nitrate de lithium et oxyde de lithium) est pré-fritté à une température comprise entre 670°C et 800°C. On obtient un composé constitué de TiO2 et de Li2TiO3 ou un composé constitué de TiO2, de Li2TiO3 et de Li4Ti5O12. Le composé est ensuite fritté à une température de l’ordre de 800 à 950°C. [Tetsuya Yamawaki et al., brevet américain 6,645,673 B2, 2003 attribué à Toho Titanium Co. Ltd, Chigasaki].
La batterie rechargeable SCiB™ de Toshiba (https://www.scib.jp/en/)
Le SCiB™ utilise de l’oxyde de titane et de lithium (LTO) dans son anode pour obtenir une sécurité, une longue durée de vie, des performances à basse température, une charge rapide, une puissance d’entrée/sortie élevée et une grande capacité effective. SCiB™ a trouvé de larges applications dans les véhicules, l’industrie et les infrastructures, notamment les automobiles, les bus, les wagons, les ascenseurs et les centrales électriques.
Production de séparateurs pour batteries lithium-ion
Deux types de procédés sont disponibles : humide et sec. Les fabricants japonais utilisent un procédé humide dans lequel le polymère est dissous dans l’huile. L’huile est ensuite évaporée pour laisser un film poreux. Ils utilisent des polymères de poids moléculaire très élevé pour produire Celgard. Trois couches de film polymère soufflé sont laminées, étirées et recuites en dessous du point de fusion pour contrôler la structure du polymère. La feuille est ensuite rapidement étirée pour obtenir la porosité.
Deux types de procédés sont disponibles : humide et sec. Les fabricants japonais utilisent un procédé humide dans lequel le polymère est dissous dans l’huile. L’huile est ensuite évaporée pour laisser un film poreux. Ils utilisent des polymères de poids moléculaire très élevé pour produire Celgard. Trois couches de film polymère soufflé sont laminées, étirées et recuites en dessous du point de fusion pour contrôler la structure du polymère. La feuille est ensuite rapidement étirée pour obtenir la porosité.
[Pekala, R.W., et al, 2000, « Separators : An Overlooked Opportunity to Enhance Battery Performance « , 17e séminaire international et exposition sur les batteries primaires et secondaires, Ft. Lauderdale, Fla. 6-9 mars 2000].
Ce processus est très sensible aux conditions d’exploitation et varie même avec les lots de matériaux, ce qui nécessite un contrôle minutieux [Linda Gaines et Roy Cuenca, Cost of Lithium ion batteries for Vehicles, ANL Report ANL/ESD-42, May 2000, pp. 20 ].
Cependant, l’épaisseur supplémentaire requise dans les séparateurs pour les cellules EV/HEV compense la réduction de la résistance. [Y. Nishi, in : M. Wakihara, O. Yamamoto (Eds.), Lithium Ion Batteries, Wiley/VCH/Kodansha, Tokyo, 1998, p. 195.
P. Arora, Z. Zhang, Chem. Rev. 104 (2004) 4419].
En plus des caractéristiques classiques telles que la bonne résistance mécanique, la perméabilité à l’électrolyte, ces séparateurs micro-poreux présentent une propriété protectrice lors de l’abus de cellules. Par exemple, si la température de la cellule s’élève anormalement à cause d’une surcharge excessive, la chaleur générée ramollit le PE et ferme les micropores du film. Ce phénomène est appelé
séparateur « shutdown ».
Une fois que l’arrêt se produit, le transport ionique entre les électrodes est effectivement arrêté et le courant cesse de circuler. Si le séparateur peut conserver son intégrité mécanique au-delà de sa température d’arrêt, il peut fournir une marge de sécurité au dispositif ; dans le cas contraire, les électrodes peuvent entrer en contact direct, réagir chimiquement et entraîner un emballement thermique.
Cependant, il est possible qu’en raison de l’inertie thermique, la température continue à augmenter même après l’arrêt. Dans de telles conditions, le séparateur fondrait et court-circuiterait les électrodes, entraînant des réactions violentes et un dégagement de chaleur. Ce phénomène est appelé « fusion » ou « rupture » du séparateur. Par conséquent, afin de garantir la sécurité de la cellule, la différence entre les températures d' »arrêt » et de « fusion » doit être aussi grande que possible.
Les séparateurs entièrement fabriqués en polyéthylène haute densité fondent à 135°C et perdent leur intégrité mécanique au-delà de cette température. Cependant, les séparateurs fabriqués en laminant des couches de polypropylène et de polyéthylène conservent leur intégrité mécanique au moins jusqu’à 165°C, le point de fusion du polypropylène. Il est intéressant de noter que, bien que le polyéthylène de poids moléculaire très élevé fonde à 135°C, les séparateurs fabriqués à partir de ce matériau conservent leur intégrité mécanique jusqu’à au moins 180°C car la viscosité du matériau est telle qu’il conserve son intégrité physique.
Les séparateurs d’arrêt sont fiables et les fabricants de batteries lithium-ion optent de plus en plus pour leur incorporation dans leurs produits. Les séparateurs d’arrêt les plus courants sont constitués de polypropylène à haut poids moléculaire mélangé à du polyéthylène à très haut poids moléculaire. Ici, la propriété d’arrêt unique du polyéthylène est combinée favorablement avec l’intégrité mécanique élevée du polypropylène à des températures élevées. Comme l’arrêt est irréversible, une fois actionnés, ces séparateurs laissent les cellules définitivement endommagées. [ P.G. Balakrishnan, R. Ramesh, T. Prem Kumar, J. Power Sources. 155 (2006) 401-414]
Autres matériaux dans Batterie lithium-ion
Il existe d’autres matériaux tels que les collecteurs de courant comme les feuilles d’aluminium, de nickel et de cuivre, les liants comme lecopolymère styrène-butadiène (SBR) et lepolyfluorure de vinylidène (PVDF), les électrolytes et les solvants, les additifs conducteurs de la cathode, le séparateur.
Avantages et limites de la batterie lithium-ion - Fabrication de cellules lithium-ion
Rapport de poids anode/cathode
Il est très important qu’aucun lithium métal ne se forme pendant le fonctionnement de la pile. Le dépôt du métal forme des dendrites qui court-circuitent la cellule. Le contrôle de la tension pendant la charge et l’équilibre des cellules permettent de réduire ce problème dans une très large mesure. La principale méthode pour contrôler le dépôt de lithium est le rapport entre la capacité anodique et la capacité cathodique des différentes plaques de la cellule. L’électrode anodique a une capacité utile d’environ 10 % supérieure à celle de la cathode. Cela empêche le dépôt de lithium métallique sur l’anode pendant la charge, car la cathode détermine la capacité de la cellule. Si le lithium métallique se dépose à la surface de l’électrode, il réagit avec l’électrolyte et peut provoquer un emballement thermique.

Figure 21. Rapport entre la capacité de l’anode et celle de la cathode dans une cellule lithium-ion
(Crédit : Ralph J. Brodd et Kazuo Tagawa, dans Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk et Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 272, 2002).
Procédés d'assemblage des cellules lithium-ion
Les processus d’assemblage des cellules d’une batterie lithium-ion exigent précision et exactitude lors de l’enrobage des électrodes positives et négatives recouvertes de la matière active. Le processus de revêtement est un élément essentiel pour garantir un produit de haute capacité et de haute fiabilité. Si les revêtements sont de mauvaise qualité, seules des batteries de faible performance seront produites. Les premières étapes de la préparation de la masse active déterminent le résultat.
Cohen et Gutoff [E. Cohen et E. Gutoff, Modern Coating and Drying Technology, Wiley-VCH,
New York, 1992] décrivent une méthodologie permettant de déterminer la meilleure technique de revêtement pour une application particulière, en fonction de la rhéologie de la suspension de revêtement, de la précision requise et de la vitesse de revêtement.

Figure 22. Procédé de revêtement de l’anode et de la cathode
(Crédit : Ralph J. Brodd et Kazuo Tagawain dans Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk et Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 273, 2002).
Organigramme pour la fabrication d'une batterie lithium-ion

Figure 23. ORGANIGRAMME POUR LA FABRICATION DE CELLULES LITHIUM-ION
[Ralph J. Brodd et Kazuo Tagawa en Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk et Bruno Scrosati (Eds.), Kluwer Academic Publishers, New York, p. 271, 2002].

Crédit : Electropaedia https : //www.mpoweruk.com/battery_manufacturing.htm
Figure 24. Organigramme pour la fabrication d’électrodes à partir de matières premières
Assemblage de cellules lithium-ion




Les fabricants de batteries lithium-ion visent les points suivants lors de l’assemblage des cellules :
- La conception de la cellule lithium-ion doit permettre d’obtenir une densité de courant uniforme sur toute la surface de l’électrode.
- Pour assurer un bon contact entre les matériaux actifs (AM) et le collecteur de courant
- Des électrodes à grande surface sont utilisées pour donner aux cellules un rendement élevé. Cela réduit la polarisation, c’est-à-dire les pertes de tension dues à la cinétique des réactions des électrodes, et diminue la chute de tension aux bornes du séparateur.
La structure des pores et la combinaison des carbones conducteurs permettent un bon contact interparticulaire de la matière active.
Unbon contact est essentiel entre les matériaux actifs, le carbone conducteur et le collecteur de courant, pour une utilisation complète des matériaux actifs et pour une bonne efficacité lors des performances à haut débit.
Lemélange de cathodes au cobalt est préparé à partir de LiCoO2 (une poudre noire) + un liant PVdF (un thermoplastique fluoropolymère semi-cristallin blanc) + de la N-méthyl pyrrolidone (NMP, un liquide organique incolore) comme solvant. Le LiCoO2 étant non conducteur, un diluant conducteur, invariablement un noir de carbone, est ajouté pour améliorer la conductivité du LiCoO2.
Le rapport et les quantités des matériaux sont déterminés par la conception de la cellule et la taille du mélangeur. Une procédure de mélange intensive est utilisée pour mélanger à sec la matière active non conductrice et le carbone avant d’ajouter le solvant de revêtement et le liant.
Le mélange est mélangé à sec afin d’obtenir un revêtement uniforme des particules de la matière active avec une fine pellicule de carbone conducteur, de manière à améliorer le contact électrique entre l’AM et la grille du collecteur de courant (feuille d’aluminium de 20 mm d’épaisseur), ce qui garantit la pleine utilisation de tout l’AM. Le polymère NMP est dissous dans le solvant de revêtement dans un récipient séparé. Le mélange sec et la solution de solvant sont ensuite combinés pour former une bouillie.
Les ajouts de solvants sont utilisés pour ajuster la viscosité de la suspension (ou de la peinture) pour l’opération derevêtement . Le polyfluorure de vinyle (PVdF) est le liant de prédilection et le système de gestion de la qualité de l’eau. Le solvant est la N-méthylpyrollidinone (NMP). La boue issue de l’opération de mélange est placée dans des conteneurs scellés, qui servent de réservoir et de moyen de transfert pour les opérations de revêtement. Des quantités précises de boue de revêtement sont pompées du conteneur de stockage à l’aide d’une pompe à engrenages, ou d’une pompe de précision similaire, afin d’éviter tout entraînement d’air dans le fluide allant vers la tête de revêtement.
Lemélange anodique est préparé de manière similaire avec du carbone dur, du liant PVdF et du NMP. Ce mélange est appliqué sur une feuille de cuivre utilisée comme grille (10 mm d’épaisseur).
Le revêtement est effectué sur les deux faces sur une épaisseur d’environ 100 mm pour les anodes et les cathodes. En diminuant l’épaisseur du revêtement, on obtient une augmentation de la surface totale pour un volume défini de la cellule. Les électrolytes organiques utilisés ont une conductivité plus faible que les électrolytes aqueux, et cette surface plus élevée facilitera l’obtention d’une cellule de décharge à haute puissance.
L’épaisseur de l’électrode dépend de la puissance maximale requise. L’une des caractéristiques uniques de la technologie de fabrication des batteries lithium-ion est qu’elle permet de concevoir une large gamme de rapports puissance/énergie avec la même technologie de fabrication des électrodes. [Broussely, Nazri pp 651]. Mais il est important de bien collecter le courant, de le tabuler, de façonner et de concevoir les cellules.
Assemblage des cellules : La feuille enduite passe dans un four pour évaporer le solvant et laisser une quantité précise de masse active sur la feuille. De nombreux solvants de revêtement sont classés comme dangereux et ne peuvent être rejetés dans l’atmosphère. Par mesure d’économie, le solvant est généralement récupéré pour être réutilisé dans le processus. Pour éviter toute contamination de l’environnement, le solvant peut être incinéré.
La plupart des cellules lithium-ion sont de forme cylindrique. Le rouleau de gelée est aplati pour obtenir des éléments pour les cellules prismatiques.
Les cellules prismatiques sont favorables à un meilleur remplissage du volume, mais sont susceptibles de se bomber en cas de cyclage ou de vieillissement. Les boîtes à cellules cylindriques offrent une meilleure résistance mécanique, une bonne stabilité dimensionnelle et une pression uniforme dans les éléments.
L’opération de revêtement produit un revêtement interrompu correspondant à la longueur de la bobine. Les bobineuses sont conçues pour fonctionner automatiquement pour une utilisation avec des rouleaux jumbo de cathodes et d’anodes séchées et de séparateurs (25 mm ou moins d’épaisseur, soit PP ou PE ou mixte).
Les opérations commencent par le soudage des languettes sur la partie non recouverte des feuilles. La machine à bobiner coupe ensuite la bande à la longueur appropriée et enroule la combinaison anode-séparateur-cathode en une bobine serrée à la manière d’un rouleau de gelée. Au fur et à mesure que le diamètre du noyau enroulé augmente, la machine à bobiner compense automatiquement pour maintenir une tension constante à mesure que le diamètre de la bobine augmente, pour une tolérance étroite sur le diamètre. Le vent elliptique pour les cellules prismatiques est un processus plus complexe et plus lent.
Après le bobinage, la bobine est vérifiée pour détecter les courts-circuits internes avant d’être insérée dans la boîte. Les boîtes en acier doivent être propres et nickelées afin de fournir une surface stable et de minimiser la corrosion des boîtes avant l’assemblage des cellules. Le fil de l’anode est soudé au fond de la boîte et le fil de la cathode est soudé à l’évent de sécurité. L’électrolyte est ajouté à la cellule semi-assemblée. L’assemblage se termine par le sertissage du couvercle supérieur.
Le rejet précoce des cellules potentiellement défectueuses est une mesure économique et évite de travailler davantage sur les mauvaises cellules. La bobine est insérée dans la boîte de manière à ce que celle-ci exerce une pression constante pour maintenir les composants de l’élément proches les uns des autres, éliminant ainsi tout risque de vide entre eux. Certains fabricants peuvent insérer un mandrin pour stabiliser le centre de la bobine.
A moins que toutes les opérations ne soient effectuées dans une
chambre sèche ou boîte sèche
l’eau absorbée dans les matières actives doit être éliminée par la chaleur et le vide avant le processus de remplissage de l’électrolyte.
Le remplissage sous vide de l’électrolyte est effectué avec précision afin de garantir que l’électrolyte pénètre et remplit complètement la porosité disponible dans les structures du séparateur et de l’électrode. Des pompes de précision dosent le volume calculé d’électrolyte nécessaire au bon fonctionnement de la cellule. Invariablement, tous les fabricants emploient le LiPF6 (un composé inorganique cristallin blanc) comme électrolyte et les carbonates cycliques (EC, carbonate d’éthylène) ou linéaires (DMC, carbonate de diméthyle, DEC, carbonate de diéthyle, ou EMC, carbonate d’éthyl-méthyle, etc.
Les électrolytes basés sur des mélanges de solvants de carbonate d’éthylène (EC) avec du carbonate de diméthyle (DMC) et/ou du carbonate de diéthyle (DEC) sont couramment utilisés pour les batteries lithium-ion en combinaison avec des cathodes « 4 V » (cobaltate, nickelate et manganate) en raison du potentiel d’oxydation élevé des solvants.
Après avoir rempli la cellule d’électrolyte, la cellule est scellée par la compression contrôlée d’un joint ou d’une bague en polymère placé entre le boîtier de la cellule et la plaque supérieure. La pression exercée sur le joint d’étanchéité en polymère est contrôlée pour la maintenir dans la limite élastique du polymère. Si les limites élastiques sont dépassées, le polymère s’écoule à froid et compromet l’étanchéité.
Chaque fabricant utilise une construction mécanique quelque peu différente pour sceller les cellules, mais les résultats finaux sont essentiellement identiques. Généralement, un épaulement ou un rebord est formé près du sommet de la cellule. Elle sert de base au joint d’étanchéité et permet de maintenir la bobine en place et d’empêcher le télescopage ou le changement de position de la bobine sous l’effet des vibrations et des chocs.
Tout changement de position entraîne une modification de la distribution du courant et se traduit par une mauvaise durée de vie ou un placage de lithium dans les cellules à haute performance. Le joint de la plaque supérieure de la cellule contient un évent, un élément à coefficient de température positif (PTC) et un dispositif de sécurité d’interruption de courant (CID). Le CID et le PTC sont tous deux des dispositifs de sécurité conçus pour s’activer et empêcher les températures et les pressions dangereuses de se développer à l’intérieur de la cellule. Le bon fonctionnement de chaque lot de dispositifs est vérifié avant d’être incorporé dans l’assemblage supérieur.
Une fois le scellé appliqué, les cellules peuvent être lavées, gainées et étiquetées. Elles reçoivent un numéro de série qui permet de retracer le jour de fabrication et d’identifier tous les composants de la cellule (matériaux des électrodes, électrolyte, séparateur, etc.). Les informations sur la capacité et la tension sont stockées avec le numéro de la cellule et utilisées ultérieurement pour faire correspondre les cellules lors de l’assemblage du pack.
Les cellules peuvent être soudées au laser avec des joints verre-métal pour fournir des joints hermétiques de longue durée. Avec les cellules plus grandes, une plus grande attention doit être exercée pour assurer un fonctionnement sûr, même dans des conditions d’abus.
Si les processus décrits ci-dessus concernent les petites cellules scellées utilisées dans l’électronique portable, les processus pour les batteries industrielles plus grandes destinées au stockage de l’énergie, aux applications spatiales et aux véhicules électriques suivent le même schéma général.
Batterie lithium-ion - Formation et vieillissement
Tel qu’assemblé, les ions Li ne sont pas dopés dans le carbone de l’anode et la cellule ne présente donc aucune tension. Pendant la charge initiale, une partie des ions Li du PAM LiCoO2 est sous-dopée pour devenir Li1-xCoO2 et ces ions Lithium sont dopés dans l’anode de carbone (Cy) pour devenir LixCy. Lorsque la tension de charge atteint 4,1 à 4,2 V, la valeur de x est d’environ 0,5. (c’est-à-dire 50 %) indiquant que 50 % du Li provenant de LiCoO2 a été utilisé.
Un autre aspect à noter est qu’une partie des ions lithium dopés ne retourne pas et reste dans l’anode. où, x-dx Les ions de lithium restent sans contribuer à la capacité. Cela représente environ 10 à 20 % de lithium irréversible, ce qui signifie que l’efficacité de la charge initiale est de 80 à 90 %. À partir du deuxième cycle, la quantité irréversible n’augmente pas et la cellule présente la capacité de 100 % prévue par le fabricant.
Après le lavage et le gainage, mais avant le début du processus de formation, la tension et l’impédance de toutes les cellules sont enregistrées afin d’éliminer les cellules défectueuses. Les cellules sont ensuite chargées pour la première fois
(charge initiale ou charge de formation). Les conditions de la première accusation sont importantes pour au moins deux raisons :
1) la couche d’ interphase d’électrolyte solide (SEI) se forme sur l’anode pour la protéger de la réaction spontanée avec l’électrolyte pendant le fonctionnement normal de la cellule, et 2) elle établit le bon contact électrique entre les matériaux actifs et l’électrolyte. La première charge suit la procédure recommandée par le fabricant pour charger les cellules, mais commence souvent à un courant plus faible, puis augmente jusqu’au courant de charge normal à environ un tiers de la période de charge. Les cellules peuvent continuer à fonctionner dans les limites de tension pour la charge et la décharge pendant un ou deux cycles supplémentaires après leur formation.
Après la formation ou le cyclage, la tension et la capacité des cellules sont mesurées et stockées pour une utilisation ultérieure dans le processus de sélection des cellules. La période de vieillissement varie entre deux semaines et un mois, selon le fabricant. La tension des cellules est mesurée à nouveau après le stockage. Les différences de tension au début et à la fin de la période de stockage sont utilisées pour trier les cellules présentant des courts-circuits « mous » ou « micro ». Les cellules avec des courts-circuits internes auront une tension plus faible après le stockage et se sépareront de la distribution normale de tension et de capacité. Il peut être nécessaire de faire le vide dans les grandes cellules après la formation pour éliminer les gaz de formation.
Pour une description détaillée du processus d’assemblage, le lecteur est invité à se reporter à
- Kaoru Nakajima et Yoshio Nishi Chapitre 5 dans : Energy Storage Systems for Electronics, Ed Tetsuya Osaka et Madhav Datta, Gordon and Reach Science Publishers, Amsterdam, 2000.
- Lithium-Ion Cell Production Processes, Ralph J. Brodd et Kazuo Tagawa, Chapitre 9 in : Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk et Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, pp. 273, 2002.
- Lithium Batteries, Science and Technology, ed. par G. A. Nazri et G. Pistoia, Springer, New York, 2009.
- Lithium-Ion Batteries, Reiner Korthauer (ed) (2018), traduit par Michael Wuest et.al., Springer, 2018.
- Kazuo Tagawa et Ralph J. Brodd, Production Processes for Fabrication of Lithium-Ion Batteries in Lithium-Ion Batteries, Yoshio M., Brodd R.J., Kozawa A. (eds) Springer, New York, NY. https: //doi.org/10.1007/978-0-387-34445-4_8]
- Zhang Z., Ramadass P. (2012) Lithium-Ion Battery Systems and Technology. Dans : Meyers R.A. (ed) Encyclopaedia of Sustainability Science and Technology. Springer, New York. https: //doi.org/10.1007/978-1-4419-0851-3_663
- The Handbook of Lithium-Ion Battery Pack Design Chemistry, Components, Types and Terminology, John Warner, Elsevier, 2018.




