Axit chì phản ứng hóa học
Nguyên lý làm việc & phản ứng của pin axit-chì
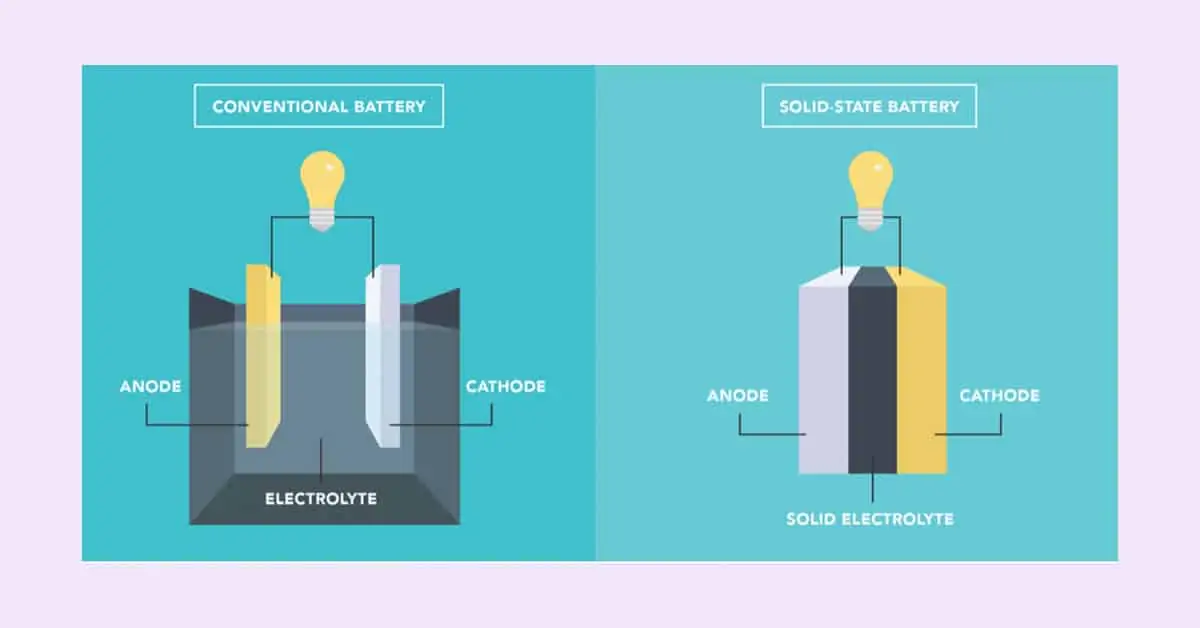
Tất cả Pin là hệ thống điện hóa hoạt động như một nguồn điện và năng lượng. Mỗi hệ thống có 2 điện cực (Dương và Âm), chất điện phân và chất phân tách. Hầu hết các hệ thống điện hóa đều có một oxit kim loại hoặc ôxy là Dương và một kim loại là Âm. Các hệ thống có thể được phân loại thêm thành pin chính và pin phụ. Pin chính chỉ sử dụng một lần; trong khi pin phụ có thể được xả và sạc lại nhiều lần.
Một số loại pin phụ đã được thành lập và thành công về mặt thương mại được đưa ra trong bảng sau:
| Hệ thống điện hóa | Điện cực dương | Phủ định | Chất điện giải | Nhận xét | ||
|---|---|---|---|---|---|---|
| Ắc quy | Chì Peroxide PBO2 | Kim loại chì ở dạng xốp | Axit sunfuric loãng | Chất điện phân được sử dụng trong các phản ứng + dẫn các ion điện tử | ||
| Pin Lithium ion | Lithium với oxit của Coban, Niken, Mangan, Sắt | Graphit, Silicon với Lithium liên kết (xen kẽ) | Hỗn hợp dung môi hữu cơ cho muối liti | Chất điện phân để dẫn ion liti giữa 2 điện cực - Không có phản ứng hóa học | ||
| Niken Cadmium | Niken oxyhydroxit Ni (O) OH | Cadmium kim loại | Kali Hydroxit loãng | Chất điện ly chỉ để dẫn các ion điện tử | ||
| Niken kim loại Hydrua | Niken oxyhydroxit Ni (O) OH | Hydro hấp thụ trong hợp kim kim loại | Kali Hydroxit loãng | Chất điện ly chỉ để dẫn các ion điện tử | ||
Phản ứng hóa học của pin axit chì:
Ắc quy Axit Chì có 3 thành phần hoạt động chính:
- Chì Dioxit (PbO₂) tạo thành điện cực dương xốp.
- Chì ở trạng thái xốp tạo thành điện cực âm xốp.
- Axit sulfuric loãng có tỷ trọng thay đổi từ 1.200 đến 1.280 trọng lượng riêng là chất điện ly. Trong pin VRLA, lượng axit thấp. Do đó, người ta thường dùng axit có trọng lượng riêng cao hơn như 1.300 -1.320 để đạt được công suất thiết kế.
Khi pin được kết nối với một tải (phóng điện), nguyên tử chì trên bản cực âm phân tách thành ion chì (Pb²⁺) và 2 điện tử. Các electron tạo thành đơn vị cơ bản của dòng điện bắt nguồn từ bản âm và chạy qua cực âm vào mạch ngoài.
Sau khi đi qua tải, các điện tử đến cực dương. Các điện tử chuyển đổi (khử) chì điôxít thành các ion chì.
Ở cả điện cực dương và điện cực âm, các ion chì (Pb²⁺) phản ứng với axit sulfuric để tạo thành DẪN SULPHATE. (Thuyết Double Sulphate của Gladstone). Trong các hệ thống điện hóa khác như pin Nickel-Cadmium, pin Lithium-ion, các chất điện phân không tham gia vào các phản ứng. Vai trò của chúng chỉ là dẫn các ion giữa hai điện cực.
Các phản ứng trong quá trình phóng điện - Phản ứng hóa học của pin axit chì
Các phản ứng trong quá trình xả (Đây là chức năng chính của pin)
Pb (Tiêu cực) → Pb²⁺ + 2 e⁻ —————————— 1
PbO₂ (Tích cực) Pb⁴⁺ + 2 e⁻ → Pb²⁺ —————————– 2
Pb²⁺ + SO₄²⁻ (từ axit) → PbSO₄ (ở cả hai điện cực) ——– 3
Trong quá trình sạc của một pin axit chì đã xả, cả 3 phản ứng đều diễn ra theo chiều ngược lại, Trên đây là các phản ứng hóa học và điện hóa đơn giản diễn ra trong pin axit chì làm cho nó trở thành hệ thống pin CÓ THỂ SẠC LẠI đáng tin cậy nhất hoặc THỨ HAI Hệ thống pin.
Sự khác biệt giữa pin chính và pin phụ là gì? Trong khi pin tiểu được sử dụng & ném & không thể sạc lại; pin phụ, on sạc, tất cả 3 thành phần – dương, âm và axit được tái sinh.
Do đó, một tế bào / pin có thể sạc lại hoặc phụ được tạo ra. Do đó tên pin phụ
Chu trình oxy bên trong - Phản ứng hóa học của pin axit chì
Trong quá trình sạc pin VRLA:
Tại bản cực dương, khí O2 được sinh ra và tạo ra các hạt proton và electron.
2H2O → 4H + + O2 ↑ + 4e- ……… Phương trình. 1
2Pb + O2 → 2PbO
2PbO + 2H 2 SO 4 → 2PbSO 4 + 2H 2 O
——————————————————
2Pb + O2 + 2H 2 SO 4 → 2PbSO 4 + 2H 2 O + Đun nóng ……… Phương trình. 2
—————————————————–
Tuy nhiên, đây là một quá trình sạc, do đó, chì sulphat được tạo ra một lần nữa phải được chuyển đổi thành chì; axit sulfuric được tạo ra theo con đường điện hóa bằng cách phản ứng với các proton (ion hydro) và các điện tử do sự phân hủy nước ở các bản cực dương khi chúng được tích điện.
2PbSO 4 + 4H + + 4e – → 2Pb + 2H 2 SO 4 ……… Phương trình. 3
Phản ứng phóng điện và sạc - Phản ứng hóa học pin axit chì
Các phản ứng của tế bào điện hoặc pin là đặc trưng cho hệ thống hoặc hóa học:
Ví dụ, ô axit chì:
Pb + PbO 2 + 2H 2 SO 4 Xả ↔ Sạc 2PbSO 4 + 2H 2 O E ° = 2,04 V
Trong ô Ni-Cd
Cd + 2NiOOH + 2H 2 O Phóng điện ↔ Điện tích Cd (OH) 2 + 2Ni (OH) 2 E ° = 1,32 V
Trong một ô Zn-Cl 2 :
Phóng điện Zn + Cl 2 ↔ Tích điện ZnCl 2 E ° = 2,12 V
Trong ô Daniel (Đây là ô chính; ở đây lưu ý sự vắng mặt của các mũi tên có thể đảo ngược)
Phóng điện Zn + Cu 2+ ↔ Tích điện Zn 2+ + Cu (s) E ° = 1,1 V
Điều gì xảy ra trong phản ứng phóng điện và tích điện bên trong tế bào? Axit chì phản ứng hóa học
Độ điện li: 2H 2 SO 4 = 2H + + 2HSO 4‾
Tấm âm: Pb ° = Pb 2+ HSO 4 + 2e
Pb 2+ + HSO 4‾ = PbSO 4 ↓ + H +
⇑ ⇓
Tấm cực dương: PbO 2 = Pb 4+ + 2O 2-
Pb 4+ + 2e = Pb 2+
Pb 2+ + 3H + + HSO 4‾ + 2O 2- = PbSO 4 ¯ ↓ + 2H 2 O
Axit sunfuric là một chất điện ly mạnh, nó được phân ly thành các ion hydro và ion bisulphat (còn được gọi là ion hydro sunphat).