Cara kerja baterai Lithium ion
Persepsi dalam domain publik adalah bahwa baterai asam timbal adalah teknologi lama. Baterai lithium ion memiliki persepsi yang berbeda, lebih modern, lebih bersih, memiliki kepadatan energi 3 atau 4 kali lipat dan masa pakai lebih lama. Dengan semua ini, kemungkinan keuntungan apa yang dapat dibawa oleh teknologi asam timbal berusia 150 tahun? Sebenarnya, semua tidak seperti yang terlihat, lihat di balik berita utama pada data yang digunakan dalam klaim pemasaran, lalu terapkan sedikit akal sehat, riset dasar, dan beberapa ilmu dasar. Anda akan menemukan bahwa cerita sebenarnya agak berbeda.
Kesalahpahaman pertama menyangkut kepadatan energi volumetrik dan spesifik. Nilai utama 4 sampai 5 kali hanya berhubungan dengan kepadatan energi spesifik dan sejumlah kimia baterai lithium ion, beberapa di antaranya masih belum digunakan secara komersial. Ara. 2 membandingkan beberapa katoda untuk sel baterai ion litium, kisaran ini berkisar dari sekitar 100Wh/kg untuk bahan kimia Li-FePO4 teraman hingga lebih dari 200Wh/kg untuk varian nikel-kobalt-aluminium oksida. Diagram baterai asam timbal diberikan di bawah ini:


Nilai ini hanya berlaku untuk tingkat sel tunggal, bukan paket atau kondisi dalam layanan. Ara. 3 menunjukkan kepadatan energi kimia baterai yang berbeda pada tingkat sel dan sistem. Kepadatan energi sel baterai lithium ion praktis berkurang setengahnya saat dipasang sepenuhnya dengan semua sambungan, pendinginan, keselamatan, dan peralatan manajemen baterai.
Keuntungan tingkat sel 3 sampai 5 kali kepadatan energi spesifik berkurang menjadi 2 sampai 3 kali. Bergantung pada kimia katoda lithium, kita hampir dapat melihat keseimbangan antara baterai lithium ion dan kepadatan energi baterai asam timbal untuk sistem baterai yang terpasang penuh di beberapa aplikasi.
Faktor lainnya, yaitu siklus hidup, juga merupakan sumber kebingungan. Berapa siklus yang dapat dilakukan baterai lithium ion sebelum kapasitasnya turun di bawah 80% dari peringkat papan namanya? Dua, tiga ribu? Tabel 1 memberikan ringkasan bahan katoda Li-ion yang berbeda untuk kinerja dan siklus hidup.
Keuntungan dari kimia baterai asam timbal
Baterai adalah perangkat yang aneh. Tidak ada yang menginginkannya, tetapi semua orang membutuhkannya. Mereka hanya dibeli saat dibutuhkan. Berapa banyak orang yang merencanakan perjalanan ke mal lokal untuk berbelanja baterai? Mereka adalah pembelian dendam dan hanya dibeli ketika benar-benar diperlukan. Seorang penjual yang baik dapat menjual kepada Anda dua pasang sepatu, dua mobil, dan mungkin dua rumah jika Anda memiliki uang, tetapi dia tidak dapat menjual kepada Anda dua baterai mobil SLI. Ketika Anda membeli baterai apakah baterai surya untuk panel surya, sepeda listrik atau sistem cadangan baterai UPS dan inverter atau baterai traksi untuk forklift , tidakkah Anda ingin tahu lebih banyak tentangnya?
Bagaimana cara kerja baterai asam timbal, apa perbedaan antara jenis dan model, dan bagaimana dengan kimia yang berbeda? Mereka bisa mahal. Dalam aplikasi komersial atau domestik berapa pengembaliannya, berapa umur dan biaya penggantian baterai asam timbal? Ukuran yang Anda butuhkan, ruang yang tersedia, efisiensi energi baterai asam timbal dan waktu pengisian ulang? Dan kemudian, ada biaya tersembunyi untuk keselamatan, pembuangan, dan jejak karbon. Artikel ini membandingkan baterai asam timbal dengan baterai lithium ion dan membahas banyak kesalahpahaman yang terkait dengan kedua bahan kimia ini.
Baterai lithium ion mana yang terbaik?
| bahan katoda | Nama pendek | Tegangan nominal | Energi spesifik Wh/kg (sel) | Siklus hidup | Komentar |
|---|---|---|---|---|---|
|
Litium Kobalt Oksida (LiCoO2) |
LCO | 3.6 | 150-200 | 500-1000 | Perangkat portabel - pelarian termal dengan biaya berlebih |
| Lithium Mangan Oksida (LiMn2O4) | LMO | 3.7 | 100-150 | 300-700 | Perkakas listrik, perangkat medis - lebih aman daripada LCO |
| Lithium Nickel Manganese Cobalt Oxide (LiNiMnCO2) | NMC | 3.6/3.7 | 150-220 | 1000-2000 | E-bikes, EV, industri - siklus hidup yang tinggi |
| Lithium Besi Fosfat (LiFePO4) | LFP | 3.2 | 90-120 | 1000-2000 | EV, SLI, Kenyamanan - paling aman dari semua bahan kimia baterai lithium ion |
| Lithium Nikel Cobalt Aluminium Oksida (LiNiCoAlO2) | NCA | 3.6 | 200-260 | 500 | Industri, EV powertrain (Tesla) TR pada 150C, CL 500 |
| Litium Titanat (Li4Ti5O12) | LTO | 2.4 | 50-80 | UPS, Tenaga Surya, EV powertrain (Honda, Mitsubishi). CL 3000-7000 - sangat aman |
Seperti yang dapat dilihat, semua termasuk dalam kisaran 800 hingga 2000 siklus. Sebagai perbandingan, baterai asam timbal yang dirancang dengan baik dapat dengan mudah mencapai lebih dari 1600 siklus hingga 80% DOD. Jadi bagaimana semua ini bertambah ketika mempertimbangkan biaya kepemilikan? Ini membawa kita ke poin berikutnya yang merupakan harga baterai timbal-asam. Berapa biaya baterai lithium-ion dibandingkan dengan baterai timbal-asam? Biaya pabrik pembuatan baterai lithium-ion? Secara alami, baterai lithium ion lebih mahal tetapi berapa banyak lagi. Sekali lagi, ini tergantung pada level yang dipertimbangkan. Siaran pers akan memberitahu kita bahwa harga Li-ion turun dan sekarang berada di kisaran 2-3 kali lipat dari asam timbal.
Betulkah? Harga rata-rata pada pencarian internet Inggris baru-baru ini untuk mendapatkan harga baterai rekreasi 12V dan 100 Ah yang tersedia secara komersial untuk baterai lithium ion dan baterai asam timbal:
baterai lithium ion $960 atau $800/kwh
Baterai asam timbal $215 atau $180/kwh
Jelas, masa pakai baterai lithium ion harus 4 kali lipat dari baterai asam timbal yang setara untuk mendapatkan nilai yang sama. Seperti yang telah kita lihat, ini tidak terjadi.


Dalam semua kasus, konstruksi baterai timbal-asam adalah yang paling hemat biaya bahkan ketika baterai timbal-asam yang lebih besar dipasang untuk memberikan penerimaan muatan yang lebih baik dan masa pakai yang lebih lama. Dalam contoh ini, aplikasinya adalah menara telekomunikasi di India. Prinsip yang sama berlaku di sebagian besar aplikasi dan geografi, terlebih lagi di iklim yang lebih dingin. Kesalahpahaman lainnya adalah bahwa Li-ion adalah teknologi yang lebih bersih dan lebih sedikit polusi daripada timbal-asam. Emisi cradle to gate untuk kimia baterai yang berbeda diberikan pada Gambar. 5 dan 6.
Gambar ini menunjukkan batas operasi untuk pembuatan baterai. Dari ekstraksi dan pengangkutan bahan mentah hingga semua langkah pemrosesan hingga ke titik di mana baterai siap dikirim.
Tabel 2 adalah situasi kehidupan nyata yang membandingkan ekonomi penggunaan baterai lithium ion dan baterai asam timbal yang bekerja selama periode hidup yang berbeda.
| item biaya | Biaya operasional harian USD | Biaya operasional harian USD |
|---|---|---|
| 3 tahun | Baterai Asam Timbal | Baterai ion lithium |
| Amortisasi | 8.30 | 16.90 |
| Diesel (terkirim) | 15.50 | 15.50 |
| Pemeliharaan | 2.46 | 2.46 |
| Listrik | 1.47 | 1.47 |
| Pengisian Baterai | 0.65 | 0.50 |
| Jumlah hari/bulan | 28.38/851 | 36.83/1105 |
| 6 Tahun | ||
| Amortisasi | 5.86 | 8.46 |
| diesel | 15.50 | 15.50 |
| Pemeliharaan | 2.46 | 2.46 |
| Listrik | 1.47 | 1.47 |
| Pengisian Baterai | 0.54 | 0.50 |
| Jumlah hari/bulan | 25.83/775 | 28.39/852 |
Data dari Argonne National Laboratories ini menunjukkan bahwa total proses manufaktur termasuk ekstraksi dan pengangkutan bahan baku untuk baterai lithium ion lebih dari 4 kali nilai asam timbal. Mengenai ekstraksi bahan, pasokan bahan katoda dasar seperti kobalt dan mangan dan lithium tidak sepenuhnya pasti. Proses ekstraksi dan pemulihan ada tetapi jumlah tambang dan lokasi manufaktur dapat membatasi pasokan jika permintaan meningkat secara signifikan. Peta geo-politik juga memprediksi ketidakpastian untuk beberapa sumber material ini.
Apakah baterai lithium ion dapat didaur ulang?
Daur ulang dan keamanan bahan kimia ini merupakan faktor penting. Diketahui bahwa hampir semua komponen dalam baterai asam timbal 100% didaur ulang sedangkan tidak ada proses komersial untuk mendaur ulang baterai lithium ion. Situasi ini dapat dimengerti jika Anda menganggap bahwa komponen Li, Co, Mn dll yang lebih mahal hanyalah sebagian kecil dari total baterai lithium ion. Misalnya, Lithium adalah sekitar 4% dari total berat sel. Tambahkan ke fakta yang jelas bahwa Lithium sangat reaktif (dasar dari kepadatan energinya yang tinggi), yang dapat dimengerti membuatnya mahal untuk mengekstraksi dari limbah.
Faktor kerumitan tambahan dengan banyak bahan berbeda dalam konstruksinya membuat daur ulang menjadi sulit, baik secara teknis maupun ekonomis. Hasil? Tidak ada insentif komersial untuk mendaur ulang baterai ini. Untuk alasan ini, fasilitas daur ulang masih dalam tahap percontohan dan sebagian besar didanai oleh pemerintah.
Saat ini, sebagian besar baterai lithium ion bekas ditimbun menunggu terobosan teknologi atau undang-undang untuk memaksa daur ulang mereka. Jika yang terakhir ini akan dilaksanakan maka akan ada biaya, pada akhirnya untuk dikonsumsi. Hal ini akan semakin meningkatkan harga sel Li-ion dibandingkan dengan jenis baterai asam timbal.
Bisakah baterai lithium ion meledak?
Akhirnya, kami memiliki keamanan. Tidak ada aplikasi baterai asam timbal sepengetahuan kami yang pernah memiliki penarikan keamanan seperti yang kami ketahui dalam kasus baterai Li-ion pada perangkat elektronik portabel dan bahkan kendaraan listrik. Ara. 7 menunjukkan apa yang terjadi pada Volvo hybrid baru di Inggris beberapa minggu yang lalu, pada saat artikel ini ditulis. Dalam hal ini baterai lithium ion-nya terbakar saat di-charge.
Baterai lithium-ion menyala
Gambar 7 Kebakaran yang disebabkan oleh baterai Li-ion di kendaraan listrik hibrida Volvo: kediaman April 2018-Inggris


Video ini menunjukkan kebakaran baru-baru ini yang disebabkan oleh baterai lithium. Mungkin karena ketidakseimbangan dalam sel dan BMS yang tidak tepat.
Bahkan ketika baterai lithium ion disimpan atau diangkut telah menjadi penyebab kebakaran yang sangat berbahaya. Meskipun kejadian ini jarang terjadi, mereka harus diakui, dan peralatan keselamatan yang sesuai serta perangkat lunak manajemen baterai harus diinstal. Pemadam kebakaran New York misalnya masih dalam proses memutuskan bagaimana mengatasi kebakaran baterai lithium ion. Ini akan sangat menyarankan bahwa langkah-langkah keamanan yang ada untuk baterai lithium ion di seluruh dunia perlu ditinjau.
Berikut adalah pemandangan dari New York Fire Department:
Kutipan artikel berita: AWS utility drive 15 Nov. 2016 “Kebakaran bukanlah masalah terbesar,” kata Rogers. Petugas pemadam kebakaran dilatih untuk menangani kebakaran, tetapi mereka perlu tahu apa yang mereka hadapi. Baterai Li-ion dapat melepaskan asam beracun dan uap yang mudah terbakar. Sebagian dari uap tersebut dikonsumsi oleh api, tetapi jika tidak, mereka dapat menyala atau menjadi masalah bagi petugas pemadam kebakaran. Masalah terbesar adalah apa yang terjadi “pasca operasi”, yaitu setelah api padam. Bahkan jika baterai dimatikan, baterai dapat menyala kembali hingga 72 jam, kata Rogers. -Lt. Divisi Operasi Bahan Berbahaya Paul Rogers Pemadam Kebakaran New York”
Baterai lithium ion atau baterai asam timbal?
Baterai lithium ion pasti memiliki karakteristik kinerja yang lebih baik daripada asam timbal. Namun, keunggulan ini sangat berkurang oleh perangkat keras tambahan yang terkait dengan persyaratan keselamatan dan manajemen. Hasil akhirnya adalah baterai asam timbal memiliki keunggulan yang berbeda, terutama ketika mempertimbangkan aplikasi yang tidak dibatasi oleh berat atau penerimaan muatan. Biaya awal yang lebih rendah dari biaya pabrik pembuatan baterai asam timbal; harga pembelian rendah dan biaya amortisasi rendah asam timbal dikombinasikan dengan dampak lingkungan yang rendah dan keamanan yang melekat, memberikan keuntungan sebagai berikut:
- Harga beli yang lebih rendah. Harganya sekitar seperempat setara Li-ion. Biaya pengoperasian yang lebih rendah memberikan total biaya kepemilikan yang lebih rendah di sebagian besar aplikasi.
- Dapat didaur ulang. Hampir 100% dari semua bahan baterai asam timbal didaur ulang. Nilai memo dapat memberikan pendapatan tambahan hingga 20% dari biaya bahan baterai. Baterai lithium tidak memiliki infrastruktur atau proses komersial untuk didaur ulang
- Keamanan. Kimia asam timbal secara inheren lebih aman daripada baterai lithium ion
- Keberlanjutan. Ada banyak sumber pasokan asam timbal yang mapan, terutama dari fasilitas daur ulang. Litium dan bahan katoda lainnya dapat dipasok dari area yang sensitif secara politik. Baik ekstraksi bahan global dan kemampuan manufaktur saat ini tidak akan mendukung peningkatan pesat dalam produksi baterai ion Lithium.
- Jejak karbon. Pembuatan baterai asam timbal memiliki tempat untuk menjejak jejak karbon sepertiga dari baterai lithium ion.
Gambar yang berbeda dengan yang dilukis oleh perusahaan baterai lithium ion. Meskipun tidak dapat dikatakan bahwa asam timbal memiliki kelemahan dalam kepadatan energi, faktanya baterai timbal-asam masih merupakan teknologi baterai yang sangat aman, kompetitif dan pilihan terbaik dalam banyak aplikasi.
Apa itu baterai lithium ion?
Bahan Katoda dan Anoda: Meskipun sel-sel nikel-metal hidrida (Ni-MH) awalnya disukai pada 1990-an, produk baterai isi ulang lithium ion komersial pertama di dunia dirilis pada 1991 oleh Sony Corporation. Selain kandungan energi yang tinggi, baik berdasarkan massa maupun volume, baterai ini juga menawarkan karakteristik suhu rendah, karakteristik beban, dan karakteristik siklus yang sangat baik. Akibatnya, dengan cepat merebut pasar dan menjadi sumber daya yang sangat diperlukan untuk peralatan audio dan video, komputer pribadi, telepon portabel, dan peralatan portabel lainnya.
Teknologi baterai canggih saat ini dimulai dengan penemuan konduktivitas ionik yang tinggi dari fase padat NaAl 11 O 17 , yang disebut natrium -alumina, oleh Kummer dan rekan kerja di laboratorium Ford Motor Co. [1. Olof Ramsrtomström, pada hadiah Nobel untuk Kimia, Latar Belakang Ilmiah Peraih Nobel Kimia 2019; 2. YFY Yao dan JT Kummer, J. Inorg. inti Kimia 29, 2453 (1967)].
Hal ini menyebabkan kesadaran bahwa transportasi ion dalam padatan sebenarnya bisa sangat cepat, dan mungkin mengarah pada berbagai teknologi baru. Tak lama kemudian, para peneliti di Ford menunjukkan bahwa seseorang dapat menggunakan elektrolit padat yang sangat konduktif untuk menghasilkan jenis baterai yang sama sekali baru, menggunakan natrium cair pada elektroda negatif dan larutan cair natrium dalam belerang sebagai elektroda positif, dengan natrium-konduktor elektrolit padat di antara [N. Weber dan JT Kummer, Proc. Sumber Daya Tahunan Conf. 21, 37 (1967)].
Seperti yang diharapkan, pertimbangan segera diberikan pada kemungkinan sistem litium analog, karena diketahui bahwa sel litium yang setara seharusnya menghasilkan tegangan yang lebih tinggi daripada sel natrium. Selain itu, lithium memiliki bobot yang lebih rendah dari sodium, keunggulan lain.
Unsur lithium tidak dapat digunakan, karena titik lelehnya yang rendah. Sebaliknya, paduan lithium padat, terutama sistem Li/Si dan Li/Al, diselidiki [ RA Huggins, J. Power Sources 81-82, 13 (1999)].
Sejumlah bahan diselidiki sebagai reaktan elektroda positif pada waktu itu, dengan sebagian besar perhatian diberikan pada penggunaan FeS atau FeS2. Setelah bereaksi dengan lithium, bahan-bahan ini mengalami reaksi rekonstitusi , dengan hilangnya fase awal dan pembentukan yang baru [DR Visser, Z. Tomczuk dan RK Steunenberg, J. Electrochem. Perkumpulan 121, 665 (1974)].
Kapan baterai lithium ion ditemukan?
Prof Whittingham mengeksplorasi interkalasi elektrokimia dalam bahan tersebut dan pada tahun 1973 mengusulkan bahan seperti elektroda dalam baterai. Pekerjaan ini menghasilkan baterai isi ulang yang berfungsi pada tahun 1976 . Sel yang berhasil terdiri dari logam litium sebagai anoda dan titanium sulfida (TiS 2 ) sebagai katoda, dengan litium heksafluorofosfat ( LiPF 6 ) sebagai elektrolit dalam propilen karbonat (PC) sebagai pelarut. Studi yang menjanjikan ini mengilhami Whittingham untuk mengeksplorasi interkalasi elektrokimia dalam bahan seperti elektroda dalam baterai. Baterai isi ulang yang berfungsi kemudian didemonstrasikan pada tahun 1976
[(a) Whittingham, MS Elektrointerkalasi dalam Transisi-Logam Disulfida. J. Kimia Soc., Kimia. komuni. 1974, 328–329.] (dengan Exxon Research and Engineering Company).
(b) Whittingham, Baterai MS Base de Chalcogénures. Paten Belgia no. 819672, 1975.
(c) Whittingham, MS Penyimpanan Energi Listrik dan Kimia Interkalasi. Sains 1976, 192 (4244), 1126-1127.
Tapi kesuksesan itu berumur pendek. Pada siklus berulang, litium logam membentuk dendrit pada permukaan logam saat bersepeda, menghasilkan korsleting.
Masalah ini memberikan dorongan untuk pencarian baru untuk solusi alternatif dan konfigurasi sel “sel transfer ion” (juga disebut “kursi goyang”), di mana kedua elektroda dapat menampung ion diusulkan.
Jika bahan elektroda positif awalnya mengandung litium dan sebagian atau seluruh litium dihilangkan selama pengisian pertama, sel mengembangkan potensi. Oleh karena itu, dimungkinkan untuk memiliki bahan elektroda positif yang bereaksi dengan litium pada potensial di atas sekitar 3V, jika bahan tersebut telah mengandung litium, dan litium ini dapat diekstraksi secara elektrokimia.
Siapa penemu baterai lithium ion?
Pendekatan ini, yang melibatkan penggunaan bahan di mana lithium sudah ada, pertama kali ditunjukkan oleh Prof. Goodenough. Contoh pertama bahan yang awalnya mengandung litium, dan secara elektrokimia menghapus litium dari bahan tersebut, adalah karya Li1−xCoO2 pada tahun 1980.
[K. Mizushima, PC Jones, PJ Wiseman dan JB Goodenough, Mater. Res. Banteng. 15, 783 (1980)] dan Li1−xNiO2
[JB Cukup Baik, K. Mizushima dan T. Takada, Jpn. J. Aplikasi fisik 19 (Suppl. 19-3), 305 (1980)]
Sejalan dengan pengembangan anoda, bahan katoda yang lebih baik juga dicari untuk memperoleh ggl sel yang lebih tinggi dalam kombinasi dengan anoda dengan potensi yang lebih tinggi daripada lithium logam. Sebuah terobosan datang pada 1979/1980 ketika John B. Goodenough dan rekan kerjanya di Oxford
University, Inggris, menemukan bahwa LixCoO2, kalkogenida logam interkalasi lainnya dari tipe MX2, dapat berfungsi sebagai bahan katoda.
[Cukup, JB; Mizushima, K. Konduktor Ion Cepat. Paten AS no. 4.357.215, 1982].
[Mizushima, K.; Jones, PC; Wiseman, PJ; Cukup bagus, JB LixCoO2 (0<x<-1): Baru
Bahan Katoda untuk Baterai Kepadatan Energi Tinggi. ibu. Res. Banteng. 1980, 15 (6), 783–789].
Struktur materialnya analog dengan Lix TiS2 dengan celah van der Waals antara kobalt dioksida (CoO2 ) lapisan di mana ion litium dapat diikat tanpa banyak ekspansi kisi. Cukup beralasan bahwa ketika X di MX2 adalah elemen elektronegatif kecil, proses penyerapan kation yang dihasilkan akan dikaitkan dengan perubahan energi bebas negatif yang besar dan tegangan sel yang tinggi (ΔG = -nFE). Dengan oksigen X, situasinya dianggap sangat menjanjikan, juga mengingat bahwa ion lithium diusulkan untuk cukup bergerak dalam susunan oksigen yang dikemas rapat.
Alasannya terbukti benar, dan bahan CoO2 menunjukkan potensi yang sangat tinggi ~4 hingga 5 V relatif terhadap Li+/Li. Studi elektrokimia dilakukan dalam hal ini dengan elektrolit yang terdiri dari lithium tetrafluoroborate (LiBF4) dalam propilena karbonat.
Penemuan ini memungkinkan penggunaan bahan anoda dengan potensi yang lebih tinggi daripada logam lithium, melanjutkan pencarian bahan karbon yang sesuai. Mempertimbangkan kesulitan memecahkan masalah interkalasi elektrokimia grafit, opsi lain diselidiki sebagai gantinya.
Di mana baterai lithium ion ditemukan?
Sebuah terobosan datang pada tahun 1985 ketika sebuah grup Jepang yang dipimpin oleh Akira Yoshino (dari Asahi Kasei Corporation) menemukan serat karbon fase uap (VGCF) dan kemudian kokas minyak bumi yang diolah dengan panas. Bahan terakhir diketahui mengandung campuran kristal (grafitik) dan domain non-kristal, dan para peneliti dapat mengidentifikasi kualitas yang sangat stabil, namun berkinerja tinggi, dengan derajat kristalinitas tertentu.
[Akira Yoshino, Kelahiran Baterai Li-Ion, Esai Angewandte, Angew., Chem. Int. Ed., 2012 , 51, 5798-5800]
Dengan bahan anoda yang efektif ini, Yoshino mengembangkan baterai lithium-ion yang efisien dan bekerja berdasarkan konfigurasi sel transfer ion. Bahan karbon yang teridentifikasi kemudian digunakan sebagai anoda dan bahan LixCoO2 Goodenough (biasanya mengandung sejumlah kecil timah) digunakan sebagai katoda. Lapisan pemisah yang digunakan terdiri dari polietilen atau polipropilen dan elektrolit terdiri dari litium perklorat (LiClO4) dalam propilen karbonat (PC).
Yoshino juga membuktikan keamanan baterai ini pada tahun 1986 dengan menjatuhkan bobot pada baterai. Tidak ada kebakaran atau ledakan yang terjadi sedangkan baterai yang menggunakan anoda logam lithium bereaksi keras.

Angka 8. Tes keamanan pertama Yoshino dengan baterai Li-ionnya pada tahun 1986.
A) Saat sebongkah besi bertabrakan dengan baterai
B) Prototipe baterai Li-ion setelah tabrakan
C) Baterai anoda Li metalik setelah tumbukan
[Sumber: Akira Yoshino, Kelahiran Baterai Li-Ion, Angewandte Essays, Angew., Chem. Int. Ed., 2012, 51, 5798-5800 ]
Penemuan dan perkembangan ini pada akhirnya mengarah pada pelepasan baterai lithium komersial
pada tahun 1991. Dengan pengembangan lebih lanjut, baterai Li-ion dikomersialkan oleh Sony pada tahun 1991 dan oleh perusahaan patungan Asahi Kasei dan Toshiba pada tahun 1992.
[Nishi, Y., Perkembangan Baterai Sekunder Lithium Ion. Kimia Rek. 2001, 1, 406–413]
Baterai didasarkan pada bahan anoda berbasis kokas minyak bumi, LixCoO2 sebagai katoda, dan elektrolit bebas air yang terdiri dari litium heksafluorofosfat (LiPF6) dalam propilen karbonat (PC). Tegangan pengisian daya tinggi (hingga 4,1 V), dengan energi spesifik tercatat ~80 Wh/kg dan kepadatan energi ~200 Wh/ liter.
Dibandingkan dengan baterai lain yang ada di pasaran pada saat itu, baterai lithium dengan cepat menjadi sangat kompetitif dan pada dasarnya membuka jalan bagi revolusi seluler yang akan datang.
Pada waktu yang hampir bersamaan, ditemukan bahwa grafit sebenarnya dapat digunakan dalam kombinasi dengan komposisi elektrolit yang sesuai. [Fong R, Sacken U von, Dahn JR, Studi Interkalasi Lithium menjadi Karbon Menggunakan Sel Elektrokimia Tidak Berair. J. Elektrokimia. Perkumpulan 1990, 137 (7), 2009–2013]
Dengan menggunakan pelarut yang mengandung etilen karbonat, yang sampai sekarang umumnya diabaikan karena titik lelehnya yang lebih tinggi, interfase elektrolit padat (SEI) terbentuk pada permukaan elektroda grafit selama siklus pengisian/pengosongan, sehingga melindungi bahan karbon dari pengelupasan dan dekomposisi lebih lanjut. . [Peled, E. Perilaku Elektrokimia Logam Alkali dan Alkali Tanah dalam Sistem Baterai Tidak Berair, Model Interfase Elektrolit Padat. J. Elektrokimia. Perkumpulan 1979, 126 (12), 2047–2051.
Penemuan ini dengan cepat diadopsi oleh komunitas baterai, dan baterai lithium-ion generasi berikutnya berdasarkan grafit sebagai bahan anoda dikembangkan. Dengan bahan anoda ini, baterai dengan tegangan pengisian 4,2 V segera diproduksi, menghasilkan kepadatan energi ~400 Wh/liter.
Perkembangan baterai lithium-ion tidak berhenti pada penemuan-penemuan penting ini, tetapi banyak perbaikan dan alternatif telah dilaporkan. Misalnya, bahan katoda baru terus diidentifikasi untuk digunakan dalam aplikasi baterai tertentu, dan dua bahan tersebut berasal dari kelompok Goodenough: bahan spinel Li1-xMn2O4 dan bahan olivin LixFePO4 (LFP).
[Padhi, AK; Nanjundaswami, KS; Cukup baik, JB Phospho-Olivines sebagai Bahan Elektroda Positif untuk Baterai Lithium Isi Ulang. J. Elektrokimia. Perkumpulan 1997, 144, 1188-1194.
Thackeray, MM; David, WIF; Bruce, PG; Cukup baik, Penyisipan Lithium JB ke Spinel Mangan. ibu. Res. Banteng. 1983, 18, 461–472].
Bahan yang terakhir dibatasi oleh potensi yang agak lebih rendah dibandingkan Li+/Li daripada LixCoO2, tetapi memiliki stabilitas tinggi dan dapat digunakan pada tingkat pengisian yang tinggi. Beberapa bahan elektroda dan sistem elektrolit lainnya juga telah ditemukan, yang mengarah ke bahan penyimpanan energi yang terus ditingkatkan untuk kepentingan masyarakat.
Jenis baterai apa yang digunakan pada kendaraan listrik?
Saat ini, sebagian besar EV menggunakan baterai Li-ion. Sebelumnya, baterai Ni-MH dan timbal-asam digunakan, tetapi penggunaannya perlahan-lahan menurun karena munculnya baterai Li-ion, yang memiliki energi spesifik yang lebih tinggi dan nilai kepadatan energi yang lebih tinggi. Energi spesifik baterai asam timbal adalah sekitar 40-50 Wh/kg sedangkan baterai Li-ion memiliki sekitar 150 Wh/kg. Nilai densitas energi untuk baterai timbal-asam adalah 80-100 Wh/liter sedangkan baterai Li-ion lebih dari 250 Wh/liter.
Sel silinder dengan katoda nikel-kobalt-aluminium (NCA) dan anoda komposit silikon/grafit, seperti yang digunakan dalam kemasan baterai Tesla terbaru (2019-2020), telah mencapai sekitar 270 Wh/kg dan 650 Wh/liter. Teknologi baru yang disebut Licerion oleh Sion Power mengklaim energi spesifik 500 Wh/kg dan kepadatan energi 1000 Wh/L dan> 450 siklus dalam sel pengembangan 0,4 Ah.
Untuk baterai kecil, kita berbicara dalam istilah Wh. Untuk sistem kapasitas yang lebih tinggi, unit kWh digunakan. Nilai Wh dibagi 103 akan menghasilkan kWh.
Jadi 850 Wh = 850/1000 = 0,850 kWh.
Sel yang digunakan pada baterai EV saat ini dapat mencapai energi spesifik nominal 140 -170 Wh/kg. Energi spesifik dari paket baterai yang dihasilkan biasanya 30 hingga 40 persen lebih rendah, atau 80 -120 Wh/kg. Pengurangan ini disebabkan oleh beberapa kabel penghubung seri dan paralel, BMS dan sistem manajemen termal (pendinginan atau pemanasan). Pada tahun 2019, persentase paket komponen non-sel telah turun menjadi sekitar 28%.
Sampai sekarang, sel pertama kali dimasukkan ke dalam modul dan kemudian dimasukkan ke dalam paket. Keduanya Kontemporer Amperex Technology Co. Terbatas, Cina ( CATL) dan Tesla telah memutuskan bahwa mereka ingin menyingkirkan modul dan menempatkan sel ke dalam paket secara langsung. CATL telah melakukannya dan menyebutnya teknologi cell-to-pack . Sementara informasi tentang ini langka, perusahaan mengklaim bahwa ini dapat meningkatkan energi spesifik sebesar 10-15% dan meningkatkan pemanfaatan volume sebesar 15-20%. Secara total, itu dilaporkan dapat mengurangi suku cadang yang dibutuhkan untuk paket baterai hingga 40%. [https://cleantechnica.com/2020/02/18/how-catl-lithium-iron-phosphate-batteries-could-be-leading-to-100-kwh-tesla-model-3/]
Penunjukan Baterai Lithium
Komisi Elektroteknik Internasional (IEC) dan Lembaga Standar India telah menetapkan sebutan umum untuk menggambarkan kimia dan ukuran sel Lithium-ion.
[ Sel lithium dan baterai sekunder untuk aplikasi portabel, Komisi Elektroteknik Internasional, IEC 61960-1 dan IEC 61960-2 dan IS 16047: 2012 ].
Huruf-huruf menunjukkan kimia dan faktor bentuk sedangkan angka-angka menunjukkan dimensi fisik sel. Huruf pertama menggambarkan kimia umum, huruf kedua menunjukkan kimia katoda spesifik dan huruf ketiga menunjukkan bentuknya.
Huruf pertama: I – Kimia ion litium
Huruf kedua : C- kobalt, F- besi, Fp – besi fosfat, N- nikel, M-mangan, Mp- mangan fosfat, T-titanium, V –vanadium dan x – lainnya.
Huruf ketiga: R-silinder, P-prismatik
Dua angka pertama yang mengikuti menunjukkan diameter dalam mm dan tiga angka terakhir menunjukkan tinggi dalam sepersepuluh mm. Dengan demikian sel yang ditunjuk ICR19/66 adalah sel ion Litium dengan katoda kobalt yang memiliki diameter yang> 18 mm dan 19 mm dan tinggi keseluruhan maksimum yaitu> 65 mm dan 66 mm.
Untuk sel prismatik, huruf awal memiliki arti yang sama tetapi dua angka pertama menunjukkan lebar dalam mm, dua angka berikutnya adalah tinggi dalam mm dan dua angka terakhir adalah panjang dalam mm. Dengan demikian, penunjukan sel IMP9/35/150 menggambarkan sel ion Litium prismatik dengan sel katoda mangan yang ketebalan maksimumnya adalah > 8 mm dan 9 mm dan lebar maksimum yaitu > 34 mm dan 35 mm dan tinggi keseluruhan maksimum yaitu > 149 mm dan 150 mm.
Bagaimana Cara Kerja Baterai Lithium-ion?
bagaimana baterai lithium ion dibuat
Logam litium dengan nomor atom 3, densitas 0,534 g/cc, memiliki potensial reduksi standar yang sangat rendah (kopel Li + /Li -3,05 V vs. SHE) dan kapasitas spesifik teoritis 3860 Ah/kg (2061 mAh/cc) adalah berat paling ringan, tegangan tertinggi, dan kepadatan energi terbesar dari semua logam. (Bandingkan dengan timbal nomor atom 82, densitas 11,29 g/cc, kapasitas spesifik teoritis 257,8 Ah/kg dan potensial reduksi standar -0,35V vs. SHE).
Baterai lithium ion - Bahan Aktif
Bahan aktif dari elektroda positif adalah salah satu dari oksida campuran seperti LiCoO2 atau LiMnO2 atau LiFePO4. Elektroda negatif terutama grafit dan senyawa karbon amorf. Elektrolit organik (mengandung garam penghantar litium terdisosiasi seperti LIPF6) digunakan. Sebuah polypropylene (PP) atau polyethene (PE) atau pemisah campuran digunakan. Ion lithium bermigrasi bolak-balik antara elektroda baterai lithium-ion selama pengisian dan pemakaian dan diselingi ke dalam bahan aktif seperti yang dijelaskan di bawah ini:

Gambar 9. Tampilan meledak dari sel ion Lithium
Kredit: Zhang Z., Ramadass P. (2012) Sistem dan Teknologi Baterai Lithium-Ion. Dalam: Meyers RA (eds) Encyclopaedia of Sustainability Science and Technology. Springer, New York, NY, hal 6124. http://doi.org/10.1007/978-1-4419-0851-3_663
Bagaimana pengisian baterai lithium ion
Selama proses pelepasan dalam sel ion litium (LIB) ion litium dari anoda dide-interkalasi (atau diekstraksi) ke dalam elektrolit dan ion litium dari elektrolit ini diinterkalasi ke dalam bahan katoda . Pergerakan ion dari anoda ke katoda ini disertai dengan pelepasan elektron yang mengalir di sirkuit eksternal. Proses sebaliknya terjadi selama proses pengisian dimana ion lithium bergerak dari katoda dan interkalasi di anoda melalui elektrolit . LIB komersial biasanya menggunakan oksida logam transisi seperti LiCoO 2 , LiMn 2 O 4 , dan LiFePO 4 sebagai bahan katoda, yang dilapisi di atas kolektor arus aluminium.
Sepuluh hingga dua puluh persen karbon konduktif dan %–10% polimer seperti polivinilidena difluorida (PVDF) dan politetrafluoroetilena (PTFE) juga ditambahkan bersama dengan bahan aktif untuk meningkatkan konduktivitas elektronik dan masing-masing mencapai adhesi yang lebih baik dari bahan elektroda. Bahan anoda dilapisi di atas kolektor arus tembaga dengan karbon konduksi dan PVDF jika diperlukan.
Kedua elektroda dipisahkan oleh pemisah berpori (film polietilen atau polipropilen dengan ketebalan 10-20 m) yang direndam dalam larutan elektrolit (LiPF6 dalam pelarut organik). Pemisah dan larutan elektrolit harus memiliki konduktivitas ionik yang lebih baik. Sel biasanya dibuat dalam selubung logam dengan cara jellyroll dengan pemisah yang dicelup elektrolit di antara dua elektroda. Skema LIB ditunjukkan pada gambar, di mana proses pengisian dan pengosongan tipikal ditampilkan.
Baterai isi ulang lithium-ion (Li-ion) menggunakan penyisipan/ekstraksi reversibel dari ion lithium (Li + ) (spesies tamu) ke dalam atau dari matriks induk (bahan aktif elektroda positif dan negatif) yang disebut senyawa penyisipan lithium ketika pelepasan dan pengisian proses terjadi. Baterai lithium ion telah disebut sebagai baterai kursi goyang karena ion lithium “bergoyang” bolak-balik antara elektroda positif dan negatif saat sel diisi dan dikosongkan.
Bahan aktif positif biasanya oksida logam dengan struktur berlapis, seperti lithium kobalt oksida (LiCoO 2 ), atau bahan yang memiliki struktur terowongan, seperti lithium mangan oksida (LiMn 2 O 4 ) , sebagian besar pada kolektor arus aluminium . Bahan aktif negatif biasanya karbon grafit , juga bahan berlapis, sebagian besar pada kolektor arus tembaga. Dalam proses charge-discharge, ion lithium dimasukkan atau diekstraksi dari ruang interstisial antara lapisan atom bahan aktif.
Elektrolit non-air atau elektrolit organik digunakan dalam sel litium.
Separator untuk baterai lithium-ion adalah polyolefin microporous film polyethylene (PE) dan polypropylene (PP).
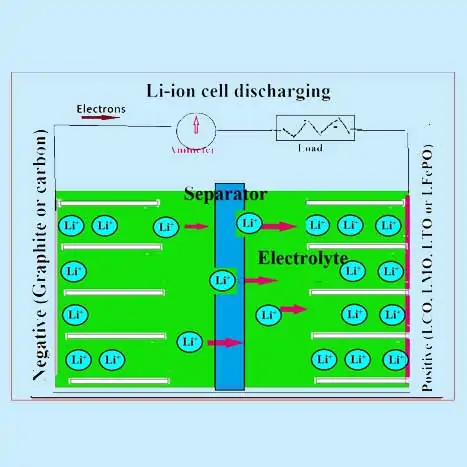

Reaksi sel elektrokimia dalam baterai lithium ion
Dalam sel ion Lithium yang khas, reaksi umum berikut terjadi.
Reaksi elektroda positif:
LiMO 2 Li 1-x MO 2 + x Li + + xe –
Reaksi elektroda negatif:
C + y Li + + kamu – Li y C
Reaksi sel total:
LiMO 2 + x/y C x/y Li y C + Li 1-x MO 2
M = logam seperti Co, Mn, Ni, Ti, dll.
Biasanya x sekitar 0,5 dan y sekitar 0,16, oleh karena itu x/y sekitar 3. [Jeff Dahn dan Grant M. Ehrlich. “Baterai lithium ion”, Buku Pegangan Linden tentang Baterai, edisi ke- 4, Thomas B. Reddy (Ed.), McGraw
Elektrolit dan Interfase Elektrolit Padat (SEI)
Seperti disebutkan sebelumnya, elektrolit non-air atau elektrolit organik digunakan dalam sel lithium. Li-sel beroperasi pada tegangan yang relatif lebih tinggi, hingga 4,2 V per sel. Meskipun garam lithium besar seperti lithium hexafluorophosphate (LiPF6), lithium hexafluoro arsenate (LiAsF6), lithium tetrafluoroborate (LiBF4), lithium perchlorate (LiClO4), lithium trifluoromethanesulphonate (LiCF3SO3), Lithium difluoro(oxalate)borate (LIODFB) dll. , adalah elektrolit yang sebenarnya (mempertahankan garam elektrolit), mereka membutuhkan pelarut yang sesuai stabil pada tegangan yang lebih tinggi tersebut. Sebagian besar pelarut tersebut memiliki konstanta dielektrik yang tinggi, memfasilitasi disosiasi ionik yang lebih mudah dan keberadaan ion Li yang sangat terkonsentrasi. Pelarut tersebut juga berfungsi sebagai selubung solvasi untuk keberadaan ion Li yang stabil, sehingga mengurangi pengaruh anion lawan.
Kerugian dari memiliki konstanta dielektrik yang tinggi adalah bahwa mereka memiliki nilai viskositas yang lebih tinggi yang mengakibatkan gangguan mobilitas ion. Untuk mengatasi konduktivitas ionik yang lebih rendah, pelarut dengan kekentalan rendah biasanya dicampur dengan pelarut dengan kekentalan tinggi. Tetapi, karena pelarut dengan kekentalan rendah memiliki disosiasi ionik yang lebih rendah, maka menjadi penting untuk mencapai rasio pencampuran yang optimal sehingga campuran memiliki konduktivitas ionik yang baik dan mobilitas yang baik. Sebagai pelarut tidak berair, campuran etilen karbonat (EC) dengan alkil karbonat linier yang kurang kental seperti dimetil karbonat (DMC), dietil karbonat (DEC), dan etil metil karbonat (EMC) digunakan dalam LIB yang tersedia secara komersial.
Pelarut aprotik adalah eter, ester dan alkil karbonat: Mereka adalah dietil eter (DEE), tetrahydrofuran (THF), dioksolana, etilen karbonat (EC), propilen karbonat (PC), dimetil karbonat (DMC), dietil karbonat (DEC), etil metil karbonat (EMC), metil format, -butirolakton (BL), metil asetat, asetonitril (AN), dimetil sulfoksida (DMSO), dimetilformamida (DMF), metil klorida, nitrometana, dll.)
Elektrolit cair adalah larutan garam litium dalam satu atau lebih pelarut organik, biasanya karbonat
Propilen karbonat (PC) tidak dapat digunakan sebagai elektrolit jika grafit digunakan sebagai anoda, karena anoda terurai pada permukaan grafit; PC yang digunakan sendiri, tanpa EC atau sedikit tambahan LiBOB) Li bisoxalato borate), dapat menyebabkan degradasi pada elektroda grafit karena berinterkalasi dengan litium, yang mengakibatkan pengelupasan.
Elektrolit tidak berubah (jumlah ion yang masuk sama dengan yang keluar dari elektrolit selama pengisian dan
memulangkan). Garam elektrolit biasanya dilarutkan dalam pelarut karbonat organik. Setiap produsen memiliki kombinasi pelarut yang berbeda dengan etilen karbonat (EC) menjadi penyebut umum untuk sebagian besar
Pembentukan lapisan interfase elektrolit padat (SEI) adalah fungsi penting lain yang dilakukan oleh elektrolit. Ketika logam alkali direndam dalam elektrolit baterai, atau ketika potensial negatif diterapkan pada karbon atau elektroda inert yang direndam dalam elektrolit, SEI mulai terbentuk.
Lapisan SEI yang terbentuk seketika setelah kontak logam dengan larutan, terdiri dari produk reduksi komponen elektrolit yang tidak larut dan larut sebagian. SEI adalah faktor kunci yang menentukan keamanan, kemampuan daya, morfologi deposit lithium, umur simpan, dan masa pakai baterai. Adhesi yang baik ke anoda juga penting.
Seperti ditekankan di atas, baterai alkaline atau alkaline-earth primer atau sekunder yang praktis dapat dibuat hanya jika pembubaran atau korosi anoda dapat dihentikan. Oleh karena itu, elektrolit harus dirancang untuk mengandung setidaknya satu prekursor SEI yang bereaksi cepat dengan litium (atau dengan anoda logam alkali) untuk membentuk interfase padat-elektrolit yang tidak larut. Produk dari reduksi anion garam biasanya adalah senyawa anorganik seperti LiF, LiCl dan Li2O , yang mengendap pada permukaan elektroda. Pengurangan pelarut diikuti oleh pembentukan kedua komponen SEI yang tidak larut seperti Li 2 CO 3 dan semi karbonat dan polimer yang larut sebagian.
Dalam kasus elektroda karbon, tegangan di mana SEI terbentuk tergantung pada jenis karbon, sifat katalitik permukaannya (kandungan abu, jenis bidang kristalografi, rasio bidang basal-ke-tepi), suhu, konsentrasi dan jenis pelarut, garam dan pengotor, dan pada kerapatan arus. Pada pengisian pertama baterai lithium-ion, ada kehilangan kapasitas yang disebut “kehilangan kapasitas ireversibel” (Q IR ) yang terutama diperlukan untuk pembentukan SEI.
Selain pembentukan SEI, Q IR mungkin disebabkan oleh hilangnya kapasitas yang terkait dengan pembentukan produk reduksi terlarut (Q SP ).
SEI bebas kontaminasi sangat penting untuk masa pakai baterai yang lama. Ini menjadi lebih penting selama bersepeda dengan kecepatan tinggi dan pada debit yang lebih dalam.
SEI dalam larutan lithium hexafluorophosphate (LiPF6) dan lithium hexafluoroarsenate (LiAsF6) memiliki resistivitas yang lebih tinggi dibandingkan dengan larutan garam lainnya. Ini karena perubahan resistivitas yang berkontribusi pada resistensi yang dikendalikan spesies yang mengarah pada impedansi antarmuka yang tinggi dari anoda lithium dalam elektrolit LiPF6 dan LiAsF6. Selain itu, Li2CO3 dinyatakan sebagai salah satu agen pasif terbaik untuk peningkatan efisiensi siklus lithium [J Electrochem Soc.,164 (7) A1703-A1719 (2017)].
Pemisah untuk baterai lithium-ion
Pemisah untuk baterai lithium-ion adalah film mikropori poliolefin dan umumnya terbuat dari polietilen (PE) dan polipropilen (PP) yang ditarik secara uniaksial, PE yang ditarik secara biaksial atau PP/PE/PP yang ditarik secara multiaksial.
Bahan baku untuk bahan aktif dalam baterai lithium ion
Baterai lithium ion menggunakan bahan katoda yang berbeda. Anoda selalu berbasis karbon, kecuali beberapa seperti anoda titanium-niobium oksida, paduan Li-Si dll. Tabel dan gambar berikut memberikan beberapa ide tentang berbagai kimia yang digunakan dalam baterai ini.

Gambar 12. Ringkasan beberapa pilihan kimia elektroda saat ini dan masa depan untuk baterai ion Lithium. Kapasitas yang diusulkan dari Li(Si) adalah 50% dari kapasitas teoritis bahan, mirip dengan kasus yang ditemukan untuk beberapa bahan elektroda positif
[Sumber: Yu Miao, Patrick Hynan, Annette von Jouanne, dan Alexandre Yokochi, Energies 2019, 12, 1074; doi:10.3390/en12061074]
Tabel 1.
Karakteristik sel ion Lithium dengan bahan katoda yang berbeda
| Bahan Katoda | Li-Ni-Co-Al (NCA) | Li-Ni-Mn-Co (NMC) | Li-MnO2 (LMO) | Li-Besi Fosfat (LFP) | Li Titanate (LTO) | Li Kobalt Oksida (LCO) |
|---|---|---|---|---|---|---|
| Tegangan Nominal sel (V) | 3.6 | 3.65 (2.7-4.2) | 3.8 | 3.25 (2-3.6) | 3.2 | 3.6 |
| Energi spesifik teoretis (Wh/kg) | 279 | 256 | 148 | 128 (373) | 293 (175) | 274 (370) (x=0,5) |
| Kapasitas spesifik untuk katoda (Ah/Kg) Potensi vs Li/Li+ (V) | 180-200 (3.8) | 200 | 148 (4.1) | 150-170 (3.45) | 175 | 274 (3,9) (x=0,5) |
| Energi Spesifik untuk Katoda (Wh/Kg) | 680-760 | 610-680 | 410-492 548 | 518-587 544 | -- | 546 |
| Keamanan | aman | Sedang | Aman | Tinggi | Baik sekali | Sedang |
Bahan katoda dalam baterai lithium ion
Bahan katoda harus memenuhi beberapa persyaratan yang menjadi dasar pemilihan bahan elektroda positif.
- Untuk menyediakan kapasitas tinggi, bahan-bahan ini harus menggabungkan sejumlah besar lithium seperti yang dibuat.
- Lebih lanjut, material harus berinterkalasi secara reversibel dengan sedikit perubahan struktural untuk memungkinkan siklus hidup yang panjang, efisiensi ampere jam yang tinggi, dan efisiensi energi yang tinggi.
- Untuk mencapai tegangan sel tinggi dan kepadatan energi tinggi, reaksi pertukaran litium harus terjadi pada potensial tinggi relatif terhadap litium.
- Untuk memfasilitasi proses pengisian dan pengosongan tingkat tinggi, konduktivitas elektronik dan mobilitas ion litium dalam material harus tinggi.
- Bahan elektroda positif tidak boleh larut dalam elektrolit dan harus tersedia dengan harga terjangkau. Untuk meminimalkan biaya, persiapan dari bahan murah dalam proses berbiaya rendah lebih disukai
LiFePO 4 adalah pengecualian untuk aturan ini. Dalam LiFePO 4 , transportasi ion lithium yang memadai dicapai dengan menggunakan partikel elektroda yang memiliki ukuran partikel nanometer. [Jeff Dahn dan Grant M. Ehrlich. “Baterai ion lithium”, Buku Pegangan Linden tentang Baterai, edisi ke- 4, Thomas B. Reddy (Ed.), McGraw Hill, hlm. 26.6, 2011]
Bahan aktif positif (PAM) dalam sel ion Lithium bervariasi tergantung pada pabriknya. Bahan katoda dapat diklasifikasikan ke dalam tiga kategori besar [ Arumugam Manthiram, Nature Communications (2020) 11:1550]. Mereka:
Oksida berlapis - bahan katoda dalam baterai lithium ion
Beberapa oksida dari tipe umum LiMO 2 (di mana M = vanadium, kromium, kobalt dan nikel) mengkristal dalam struktur berlapis di mana ion Li + dan M 3+ menempati jalur alternatif dari struktur garam batu untuk memberikan urutan lapisan dari O-Li-OMO.
Dalam katoda oksida berlapis LiCoO 2 , perbedaan muatan dan ukuran yang besar antara ion Li + dan ion Co 3+ trivalen menyebabkan pemesanan kation yang baik, yang sangat penting untuk mendukung difusi ion litium dua dimensi dan konduktivitas yang cepat dalam bidang litium.
Bahan katoda membutuhkan tingkat kemurnian yang sangat tinggi dan harus hampir seluruhnya bebas dari pengotor logam yang tidak diinginkan – terutama besi, vanadium dan belerang.

Gambar 13. Skema sederhana dari struktur berlapis di mana ada pekerjaan alternatif dari
lapisan kation di antara lapisan ion oksida yang rapat.
[Kredit: Robert A. Huggins, Baterai Canggih, Aspek Ilmu Material, Springer, New York, 2009, p.168]
Stabilitas struktural yang baik bersama dengan konduktivitas listrik dan lithium-ion yang tinggi menawarkan karakteristik pengisian-pengosongan yang cepat dengan reversibilitas yang baik. Dengan fitur-fitur ini, LiCoO2 tetap menjadi salah satu katoda terbaik hingga saat ini dengan tegangan operasi tinggi ~4 V. Katoda LiCoO2 terpecahkan
dua tantangan utama yang terkait dengan katoda sulfida dikejar pada 1970-an. Ini memungkinkan tidak hanya peningkatan substansial dalam tegangan operasi dari< 2,5 V hingga ~ 4 V tetapi juga perakitan sel tanpa perlu menggunakan anoda lithium logam.
Spinel oksida - bahan katoda dalam baterai lithium ion
Kelas kedua katoda adalah spinel LiMn 2 O 4 . (Rumus umum adalah AB 2 O 4 ). Meskipun struktur ini umumnya digambarkan dalam koordinat kubik, struktur ini juga memiliki lapisan paralel ion oksida pada bidang (111), dan ada situs terkoordinasi oktahedral dan situs terkoordinasi tetrahedral antara bidang ion oksida. Jumlah situs oktahedral sama dengan jumlah ion oksida, tetapi ada dua kali lebih banyak situs tetrahedral. Stabilitas struktural tiga dimensi dan konduktivitas listrik dan lithium-ion yang tinggi menawarkan karakteristik pengisian-pengosongan yang lebih cepat untuk Li 1 – x Mn 2 O 4 dengan reversibilitas yang baik dibandingkan dengan LiCoO 2 .
Keuntungan penting untuk beralih dari LiCoO 2 ke LiMn 2 O 4 adalah pengurangan biaya yang signifikan karena mangan memiliki biaya dua kali lipat lebih rendah daripada Co. Namun, satu masalah kritis dengan LiMn 2 O 4 adalah pelarutan mangan dari kisi ke dalam elektrolit dengan adanya jumlah jejak (tingkat ppm) ion H + (keasaman) dalam elektrolit karena disproporsi Mn 3 yang terkenal. + menjadi Mn 4+ dan Mn 2+ dalam asam.

Gambar 14. Skema struktur spinel di mana kation didistribusikan di antara bidang ion oksida padat (111) di antara situs tetrahedral dan oktahedral [ Kredit: Robert A. Huggins, Advanced Batteries, Material Science Aspects, Springer, New York, 2009, hal.17].
Bahan katoda Lithium-Nickel-Manganese Oxide (LNMO) tegangan tinggi tampak menjanjikan dalam baterai generasi berikutnya. Tetapi batu sandungannya adalah kurangnya elektrolit yang dapat menangani tekanan baterai berbasis LNMO. Sel baterai berbasis katoda LNMO memberikan hasil yang setara dengan baterai berbasis lithium berkinerja tinggi lainnya, tetapi dengan biaya yang jauh lebih rendah.
Namun, produsen elektrolit mendapatkan hasil yang sangat menjanjikan dari penelitian & pengembangan berkelanjutan yang pada titik tertentu akan menghasilkan elektrolit yang akan berfungsi dengan baik dalam sel baterai LNMO. https://blog.topsoe.com/the-cathode-material-for-next-generation-lithium-ion-batteries-is-ready
Baru-baru ini, meningkatkan kandungan Ni dan menurunkan atau menghilangkan kandungan kobalt dalam katoda NMC menjadi jauh lebih menonjol [ Li, W., Erickson., E. & Manthiram, A. Katoda oksida berlapis nikel tinggi untuk baterai otomotif berbasis lithium , Nat. Energi 5, 26 – 24 (2020)].
Poli-anion oksida - bahan katoda dalam baterai lithium ion
Kelas oksida ketiga adalah oksida polianion. Polianion oksida seperti Fe 2 (MoO 4 ) 3 dan Fe 2 (WO 4 ) 3 ditemukan mengalami penyisipan/ekstraksi reversibel dari dua ion litium per unit rumus untuk menghasilkan Li 2 Fe 2 (MoO 4 ) 3 atau Li 2 Fe 2 ( WO 4 ) 3 baik dengan metode kimia maupun elektrokimia
[Manthiram, A., Cukup, JB Penyisipan Lithium ke dalam kerangka Fe 2 (MO 4 ) 3 : perbandingan M = W dengan M = Mo. J. Kimia Keadaan Padat. 71, 349– 360 (1987)].
Berdasarkan karya Manthiram dan Goodenough,
[Manthiram, A. & Goodenough, JB Insersi Lithium ke dalam kerangka Fe 2 (MO 4 ) 3 : perbandingan M = W dengan M = Mo. J. Kimia Keadaan Padat. 71, 349–360 (1987). Manthiram, A. & Cukup baik, penyisipan Lithium JB ke dalam kerangka Fe 2 (SO 4 ) 3 . J. Sumber Daya 26, 403–406 (1989).]
Eksplorasi fosfat yang mengandung lithium sebagai katoda mengarah pada identifikasi olivin LiFePO 4 sebagai katoda [Padhi, AK, Nanjundaswamy, KS & Goodenough, JB Phospho-Olivines sebagai bahan elektroda positif untuk baterai lithium yang dapat diisi ulang. J. Elektrokimia. Perkumpulan 144, 1188-1194 (1997] pada tahun 1997.
Tapi, kelas oksida polianion menderita konduktivitas elektronik yang buruk. [ Arumugam Manthiram, Komunikasi Alam (2020) 11:1550].
Eksplorasi fosfat yang mengandung lithium sebagai katoda mengarah pada identifikasi olivin LiFePO 4 sebagai katoda [Padhi, AK, Nanjundaswamy, KS & Goodenough, JB Phospho-Olivines sebagai bahan elektroda positif untuk baterai lithium yang dapat diisi ulang. J. Elektrokimia. Soc. 144, 1188-1194 (1997] pada tahun 1997.
Tapi, kelas oksida polianion menderita konduktivitas elektronik yang buruk. [ Arumugam Manthiram, Komunikasi Alam (2020) 11:1550].
Pembuatan bahan Katoda - Baterai ion litium
Sebelumnya, senyawa katoda oksida logam litium dibuat dari litium karbonat dan garam dari logam terpilih melalui serangkaian reaksi penggantian kimia yang dilakukan dalam larutan. Produk yang diinginkan diendapkan dan dikeringkan dengan semprotan.
LiCoO2 pertama kali dibuat dengan metode sintesis konvensional yang ditunjukkan pada gambar . Tricobalt tetraoksida (Co 3 0 4 ) dan litium karbonat (Li 2 CO 3 ) dicampur dengan baik, dilanjutkan dengan kalsinasi di aliran udara pada suhu sekitar 950ºC. Namun, dengan metode ini, sangat sulit untuk membuat partikel kasar LiCoO 2 dan hanya partikel halus dengan diameter 1-3 pm yang dapat diperoleh.
Bahan elektroda aktif halus tidak diinginkan dari sudut pandang keamanan. Dalam kasus penyalahgunaan seperti korsleting eksternal atau penghancuran, partikel halus dengan luas permukaan spesifik yang besar dengan mudah bereaksi pada satu waktu dan semua energi sel dilepaskan secara tiba-tiba dalam waktu yang sangat singkat dengan disertai kenaikan suhu. Dalam kasus terburuk, sel dapat terbakar [Yoshio Nishi, dalam Baterai Lithium ion, M. Wakihara dan 0. Yamamoto (Eds.). halaman 192-193].
Bagaimana baterai lithium ion diproduksi? diagram alir
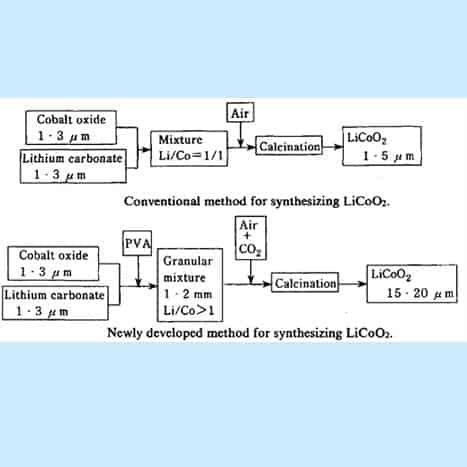
Gambar 15. Flowchart untuk membuat Li-CoO 2
[Sumber: Yoshio Nishi, dalam Baterai Lithium ion, M. Wakihara dan 0. Yamamoto (Eds.). halaman 192-193].
Proses yang ditingkatkan untuk mensintesis lithium cobaltite dengan ukuran partikel yang lebih besar: Poin pertama adalah bahwa sejumlah kecil resin PVA ditambahkan dalam campuran bahan mentah (Co 3 0 4 dan Li 2 CO 3 )) untuk membentuk pelet granular dengan granulator . Dengan sintering pelet dalam aliran udara yang mengandung gas C0 2 dalam jumlah yang sesuai, partikel lithium kobaltit dengan diameter rata-rata 20pm disintesis. Poin kedua adalah bahwa kami menggunakan jumlah litium karbonat (Li 2 CO 3 ) yang sedikit berlebihan dalam bahan baku, sehingga rasio atom Li/Co dalam bahan baku lebih besar dari satu. Prosedur ini juga menguntungkan untuk memperoleh partikel kasar, dan sebagai tambahan, LiCoO2 yang dihasilkan mengandung sedikit sisa Li2CO3 .
Poin pertama adalah bahwa sejumlah kecil resin PVA ditambahkan dalam campuran bahan mentah ( Co304 dan Li2CO3 ) untuk membentuk pelet granular dengan granulator. Dengan sintering, Litium kobalt oksida dapat disiapkan dengan pembakaran suhu tinggi dari campuran stoikiometri litium karbonat Li2CO3 dan kobalt oksida, Co3O4 atau kobalt logam pada 600–800 °C, kemudian menganil produk pada 900 ° C selama berjam-jam, semua di bawah atmosfer oksigen.
Itu juga dapat diperoleh dengan kalsinasi oksida terhidrasi dengan lithium hidroksida hingga 750-900 ° C.
Metode ketiga menggunakan litium asetat, kobalt asetat, dan asam sitrat dalam jumlah molar yang sama, dalam larutan air. Pemanasan pada 80 ° C mengubah campuran menjadi gel transparan kental. Gel kering kemudian digiling dan dipanaskan secara bertahap hingga 550 °C. (https: //en.wikipedia.org/wiki/Lithium_cobalt_oxide).
Beberapa contoh tipikal adalah: Metode sol-gel
Dalam proses sol-gel, larutan berair dari reaktan dan larutan zat pengkelat dicampur. Penguapan lambat dari pelarut menghasilkan sol dan pemanasan moderat dari sol sehingga diperoleh menghasilkan gel. Yang terakhir dikalsinasi pada suhu yang sesuai untuk mendapatkan produk yang diinginkan.
Contoh 1.
Sintesis LiCoO 2 dari zat pengompleks yang berbeda: Garam yang digunakan adalah kobalt nitrat heksa hidrat (Co(NO 3 ) 2 .6H 2 O, dan litium nitrat, LiNO 3 anhidrat. Gel diproduksi menggunakan empat zat pengompleks yang berbeda: asam sitrat, anhidrat (C 3 H 4 OH(COOH) 3 , glisin, (H 2 NCH 2 COOH); pati (pati jagung komersial dan gelatin).
Lima larutan yang mengandung LiNO 3 dan Co(NO 3 ) 2.6H 2 O dalam 20 ml air, dengan perbandingan Li:Co = 1.1:1 disiapkan. Zat pengompleks spesifik ditambahkan ke setiap larutan: ( i ) asam sitrat (4,611 g) diencerkan dalam 5 ml air; ( ii ) glisin (1,501 g); ( iii ) pati (1.250 g); ( iv ) gelatin (3.500 g) dan ( v ) uji blanko.
Empat larutan pertama dipanaskan pada suhu 70 sampai 80°C dalam penangas gliserin sampai terbentuk gel. Lamanya waktu proses ini berbeda untuk setiap bahan pembentuk gel: ( i ) asam sitrat (5 jam), ( ii ) glisin (3 jam), ( iii ) pati (1 jam), ( iv ) gelatin (3 jam) . Produksi bubuk kristal untuk semua sampel dilakukan dalam dua tahap dalam tungku meredam: pertama dengan pembakaran bahan pada 300 ° C selama 20-30 menit dan kemudian pemanasan pada 700 ° C selama 24 jam. [Bruno GA Freitas dan lainnya, J. Braz. Kimia Perkumpulan 28, 11, November 2017].
Contoh 2.
Disiapkan dengan Metode Sol-Gel
LiNO3 pertama dilarutkan dalam larutan asam sitrat. LiNO3, Ni(NO3)2.6H2O Co(Ac)2.4H2O dan Mg(NO3)2.6H2O digunakan sebagai bahan awal litium, nikel, kobalt, dan magnesium dalam LiNi 0,7 – 𝑥 M Co 0,3 O2 (0 ⩽ ⩽ 0,1), masing-masing. Jumlah asam sitrat sama dengan jumlah molar total Co, Ni, dan Mg. Kemudian, Co(Ac)2 4H2O, Ni(NO3)2 6H2O dan Mg(NO3)2 6H2O ditambahkan ke dalam campuran. Seluruh campuran dipanaskan dengan penangas air pada suhu 80∘C. Selama proses pemanasan, larutan berwarna merah muda jernih tanpa pengendapan terbentuk. Terakhir, larutan bening dikeringkan secara perlahan dan berubah menjadi gel. Xerogel dikeringkan, digiling, dan kemudian dipanaskan dalam oven pada suhu 120°C selama 12 jam.
Prekursor gel dikalsinasi pada 500 ° C di udara selama 6 jam, dan didinginkan sampai suhu kamar dalam tungku tabung. Produk yang diolah dengan panas digiling dalam mortar batu akik untuk mendapatkan bubuk. Kemudian serbuk dikalsinasi pada suhu 800oC selama 12 jam. Untuk pembuatan katoda, produk yang disiapkan pertama-tama dicampur dengan asetilena hitam dan polivinilidena fluorida (berat 80:8:12) dalam -metil pirolidon (NMP). Bubur yang diperoleh kemudian dilapisi pada Al foil dan dikeringkan pada suhu 80 o C selama 18 jam untuk pengepresan rol lebih lanjut. . [ Hailang Zhang, Kemajuan dalam Ilmu dan Teknik Material Vol 2014, ID Artikel 746341, ]

Gambar 16. Bagan alir untuk proses sol-gel untuk menyiapkan lithium manganat
( Kredit: YS Lee, YK Sun and KS, Nahm, Solid State Ionics 109 (1998) 285 seperti yang diberikan oleh, M. Pasquali, S. Passerini dan G Pistoia, dalam Baterai Lithium, Sains dan Teknologi, ed. oleh GA Nazri dan G. Pistoia, Springer, New York, (2009), hlm. 318)
Pembuatan bahan Anoda dalam baterai Lithium ion
Jalur yang mendorong menuju LIB dengan peningkatan energi dan kepadatan daya adalah pemilihan bahan anoda yang sesuai yang dapat memberikan kapasitas tinggi dan kemudahan difusi ion Li ke dalam anoda, bersama dengan siklus hidup yang baik dan bebas dari masalah keamanan.
Berdasarkan bahan prekursor, anoda karbon dapat diklasifikasikan menjadi beberapa jenis seperti yang diberikan di bawah ini.
Bahan prekursor dan parameter pengolahan menentukan sifat karbon yang dihasilkan. Bahan yang dapat digrafitisasi dengan perlakuan pada suhu tinggi (2000 hingga 3000 °C) disebut karbon lunak .
Setelah grafitisasi, gangguan turbostratik dihilangkan secara progresif dengan meningkatnya suhu, dan regangan pada material dihilangkan [T. Zheng, JN Reimers, dan JR Dahn, fisik Pdt. B 51 , 734 (1995)] Karbon keras , seperti yang dibuat dari resin fenolik, tidak dapat dengan mudah digrafitisasi, bahkan ketika diolah pada 3000 °C. Bahan jenis kokas disiapkan pada suhu sekitar 1000 ° C, biasanya dari prekursor minyak bumi aromatik [Jeff Dahn dan Grant M. Ehrlich. “Baterai ion lithium”, Buku Pegangan Linden tentang Baterai, edisi ke- 4, Thomas B. Reddy (Ed.), McGraw Hill, hlm. 26., 2011]

Gambar 17. Klasifikasi prekursor bahan anoda karbon
[Kredit: Jeff Dahn dan Grant M. Ehrlich. “Baterai ion lithium”, Buku Pegangan Linden tentang Baterai, edisi ke- 4, Thomas B. Reddy (Ed.), McGraw Hill, hlm. 26., 2011]
Goriparti membagi bahan anoda LIB menjadi tiga kategori tergantung pada mekanisme reaksinya dengan lithium [ Subrahmanyam Goriparti, Ermanno Miele, Francesco De Angelis, Enzo Di Fabrizio, Remo Proietti Zaccaria, Claudio Capiglia, J Power Sources 257 (2014) 421-443]
Kelompok interkalasi/de-interkalasi
Kategori anoda ini termasuk bahan karbon dan titanium oksida. Kapasitas penyimpanan yang terjadi melalui jalur interkalasi sangat erat kaitannya dengan luas permukaan, morfologi, kristalinitas dan orientasinya. Karbon lunak umumnya diterima dengan baik dan digunakan dalam industri baterai. Terlihat bahwa soft carbon merupakan teknologi yang cukup matang, sedangkan hard carbon dapat menjadi solusi alternatif yang menarik terutama untuk aplikasi yang membutuhkan kapasitas tinggi seperti pada sektor kendaraan listrik. Anoda Titanium Oksida sudah digunakan oleh beberapa industri baterai.


Graphene juga ditinjau secara ekstensif. Secara khusus, terlihat bahwa sifat listriknya membuat bahan ini sangat cocok untuk graphene/anoda logam hibrida (misalnya graphene dengan SnO2 dan Fe2O3). Karbon nano-tabung (CNTs) yang signifikan untuk hasil akademis yang sangat menarik, meskipun biaya produksi dapat menghambat aplikasi mereka sebagai bahan aktif anoda dalam industri baterai untuk masa depan.


Namun, untuk baterai EV besar, grafit murah biasanya lebih disukai karena pertimbangan biaya.
Dalam kategori kedua, bahan paduan seperti Si, Ge, SiO, SnO2 dijelaskan. Bahan-bahan ini dapat memberikan kapasitas yang lebih besar dan kepadatan energi yang tinggi dibandingkan dengan kelompok sebelumnya, dengan bereaksi dengan lithium dalam mekanisme elektrokimia paduan/de-paduan. Namun, proses ini menyiratkan ekspansi volume yang besar yang menghasilkan kehilangan kapasitas yang substansial saat bersepeda. Pengurangan dari dimensi massal ke skala nano, bersama dengan realisasi struktur kompleks dengan kombinasi dengan matriks konduktif, telah diusulkan untuk mengatasi masalah yang ditentukan di atas dan untuk meningkatkan kinerja anoda secara keseluruhan.
Silikon dan SnO2 dan kompositnya dengan karbon adalah bahan yang paling menjanjikan untuk aplikasi di baterai lithium masa depan, namun, cara yang murah untuk produksi massal mereka sebagai bahan anoda masih diperlukan. Di sisi lain, Ge, meskipun menarik karena sifat elektrokimia dan hasil laboratorium eksperimentalnya yang sangat baik, menderita kekurangan sebagai elemen peringkat kelima puluh dalam hal kelimpahan di kerak bumi. Oleh karena itu, tampaknya bukan pilihan yang baik untuk aplikasi massal teknologi baterai lithium.
Pada kelompok ketiga, bahan-bahan yang bereaksi dengan litium dengan cara reaksi konversi dijelaskan. Secara khusus, oksida logam/fosfida/nitrida/sulfida dipertimbangkan. Namun, bahan ini masih jauh dari pasar baterai lithium komersial yang besar, karena retensi kapasitas yang buruk dan potensi histeresis yang besar. Oleh karena itu, berbagai bentuk struktur nano dari bahan-bahan ini juga telah diselidiki untuk mengatasi masalah yang diidentifikasi di atas.
Nanoteknologi jelas merupakan pendekatan yang tangguh untuk merekayasa bahan anoda generasi berikutnya untuk baterai lithium. Untuk memanfaatkan bahan yang dijelaskan sebagai anoda yang efektif dalam LIB komersial, terutama untuk aplikasi EV, penelitian lebih lanjut diperlukan. Faktanya, perlu untuk mencapai energi yang lebih tinggi dan kepadatan daya yang lebih tinggi bersama-sama dengan pengembangan proses fabrikasi yang murah untuk sintesis skala besar bahan berukuran nano. Selanjutnya, penyelidikan mekanisme yang mengatur interaksi antara lithium dan bentuk nano dari bahan yang dijelaskan bersama dengan sifat transpor elektron pada antarmuka elektroda/elektrolit sangat penting untuk merancang bahan aktif anoda generasi berikutnya yang direkayasa oleh nanoteknologi. .
Elektroda negatif yang saat ini digunakan dalam sel litium melibatkan larutan padat litium dalam salah satu bentuk karbon. Sel litium yang beroperasi pada suhu di atas titik leleh litium harus menggunakan paduan, bukan unsur litium. Ini umumnya fase logam biner atau terner. Ada juga peningkatan minat saat ini tentang kemungkinan penggunaan paduan logam sebagai pengganti karbon pada suhu sekitar, dengan tujuan mengurangi volume elektroda, serta mencapai peningkatan kapasitas yang signifikan. [Robert A. Huggins, Baterai Canggih, Aspek Ilmu Material, Springer, New York, 2009, p.123].
Grafit bersifat amfoter, dan kation atau anion dapat dimasukkan ke dalamnya di antara lapisan graphene. Ketika kation dimasukkan, struktur grafit host mengambil muatan negatif. Contoh kation adalah Li + , K + , Rb + , dan Cs + . Ketika anion dimasukkan, struktur grafit host mengambil muatan positif, dan contoh anion adalah Br ,SO2 – , SbF6 –
Penyisipan logam alkali ke dalam karbon pertama kali ditunjukkan pada tahun 1926 [K. Fredenhagen dan G. Cadenbach, Z. Anorg. Semua Kimia 158, 249 (1926)] dan sintesis kimia lithium-karbon ditunjukkan pada tahun 1955 [ D. Guerard, A. Herold, Karbon 13, 337 (1975 )]. sinar-X percobaan spektroskopi fotoemisi menunjukkan bahwa litium yang dimasukkan melepaskan elektronnya ke karbon, dan dengan demikian struktur dapat dilihat sebagai ion Li + yang terkandung di antara lapisan karbon dari struktur grafit
[GK Wertheim, PMTh.M. Van Attekum dan S. Basu, Solid State Commun. 33, 1127 (1980)]. Sebuah tinjauan umum dari pekerjaan awal pada penyisipan spesies ke dalam grafit dapat ditemukan di
[LB Ebert, Senyawa Interkalasi Grafit, dalam Tinjauan Tahunan Ilmu Material,
Jil. 6, edisi oleh RA Huggins, Ulasan Tahunan, Palo Alto, CA (1976), hlm. 181].
Faktor penting dalam kemurnian bahan anoda adalah kebutuhan untuk menghilangkan spesies yang mengandung oksigen di permukaan karena ini akan bereaksi dengan elektrolit. Untuk mencegah reaksi ini, pabrikan memanggang grafit pada 1100ºC) dalam atmosfer pereduksi atau inert. Ini meningkatkan biaya untuk kegunaan lain, dibandingkan dengan grafit. Karbon (90%) dicampur dengan beberapa bahan lain untuk membuat pasta atau bubur anoda. Seperti katoda, polivinilidena fluorida (PVDF) digunakan sebagai pengikat (-5%), dan sejumlah kecil karbon hitam ditambahkan untuk memastikan konduktivitas. Selain itu, n-metil pirolidon (NMP) digunakan untuk melarutkan bahan untuk membentuk campuran yang seragam. Tekanan memastikan ukuran butir yang seragam (Sandi 1999).
Lithium titanate (LTO) mendapatkan banyak minat. Sel LTO beroperasi pada suhu yang lebih rendah daripada bahan kimia lainnya dan menawarkan kepadatan daya yang tinggi. Namun, sel tersebut menderita karena memiliki tegangan nominal yang lebih rendah, dalam kisaran sekitar 2,2-2,3 V per sel. [Norio Takami, Hiroki Inagaki, Yoshinao Tatebayashi, Hidesato Saruwatari, Keizoh Honda, Shun Egusa, J Sumber Daya 244 (2013) 469-475]
Bahan elektroda, biasanya grafit, mengembang sebesar 10% selama proses pengisian. Grafit mendapatkan kembali volume aslinya ketika ion litium terdeinterkalasi. Ion lithium tidak hanya akan terinterkalasi ke dalam grafit jika aluminium digunakan tetapi juga dimasukkan ke dalam konduktor, sehingga membentuk paduan aluminium-litium. Proses sebaliknya akan terjadi selama pemakaian. Aluminium akan terdegradasi setelah beberapa siklus dan tidak akan berguna sebagai pengumpul arus.
Namun, jika elektroda negatif dibuat dari litium titanat dan bukan grafit, situasinya berubah secara dramatis. Potensi elektroda Li 4 Ti 5 O 12 sekitar 1,4 V lebih tinggi dari grafit (tegangan sel sekitar 1,4 V lebih rendah, 2,2 V dibandingkan dengan 3,6 V). Hal ini akan mencegah ion litium terinterkalasi ke dalam aluminium. Oleh karena itu, aluminium lebih disukai daripada tembaga karena alasan terkait biaya dan berat. Li 4 Ti 5 O 12 digunakan terutama dalam aplikasi stasioner karena tegangan selnya yang lebih rendah. [ Călin Wurm dkk., dalam Baterai Lithium-Ion, Reiner Korthauer (ed), Diterjemahkan oleh Michael Wuest dkk., Springer, 2018. hlm. 57 ].
Proses untuk memproduksi litium titanat: Campuran titanium dioksida dan senyawa litium (salah satu dari ini: litium karbonat, litium hidroksida, litium nitrat, dan litium oksida) disinter terlebih dahulu pada suhu antara 670 °C dan 800 °C . Didapatkan senyawa yang terdiri dari TiO 2 , dan Li 2 TiO 3 atau senyawa yang terdiri dari TiO 2 , Li 2 TiO 3 , dan Li 4 Ti 5 O 12 . Senyawa tersebut kemudian disinter pada suhu dalam kisaran 800 hingga 950 ° C. [Tetsuya Yamawaki dkk., Paten AS 6.645.673 B2, 2003 Ditugaskan ke Toho Titanium Co., Ltd., Chigasaki]
Baterai Isi Ulang SCiB™ Toshiba (https://www.scib.jp/en/)
SCiB™ menggunakan litium titanium oksida (LTO) di anodanya untuk mencapai keamanan, umur panjang, kinerja suhu rendah, pengisian cepat, daya input/output tinggi, dan kapasitas efektif yang besar. SCiB™ telah menemukan aplikasi yang luas dalam aplikasi kendaraan, industri dan infrastruktur, termasuk mobil, bus, gerbong kereta api, elevator dan pembangkit listrik.
Produksi pemisah baterai ion lithium
Dua jenis proses yang tersedia: basah dan kering. Pabrikan Jepang menggunakan proses basah di mana polimer dilarutkan dalam minyak. Minyak kemudian diuapkan untuk meninggalkan film berpori. Mereka menggunakan polimer dengan berat molekul sangat tinggi untuk menghasilkan Celgard, tiga lapisan film polimer yang ditiup dilaminasi, ditarik, dan dianil di bawah titik leleh untuk mengontrol struktur polimer. Lembaran tersebut kemudian dengan cepat diregangkan untuk mendapatkan porositas.
Dua jenis proses yang tersedia: basah dan kering. Pabrikan Jepang menggunakan proses basah di mana polimer dilarutkan dalam minyak. Minyak kemudian diuapkan untuk meninggalkan film berpori. Mereka menggunakan polimer dengan berat molekul sangat tinggi untuk menghasilkan Celgard, tiga lapisan film polimer yang ditiup dilaminasi, ditarik, dan dianil di bawah titik leleh untuk mengontrol struktur polimer. Lembaran tersebut kemudian dengan cepat diregangkan untuk mendapatkan porositas.
[Pekala, RW, et al., 2000, “Separator: Peluang yang Diabaikan untuk Meningkatkan Performa Baterai?,” Seminar dan Pameran Internasional ke-17 tentang Baterai Primer dan Sekunder, Ft. Lauderdale, Florida, 6-9 Maret]
Proses ini sangat sensitif terhadap kondisi operasi dan bahkan bervariasi dengan kumpulan bahan, jadi kontrol yang cermat diperlukan [Linda Gaines dan Roy Cuenca, Biaya baterai Lithium ion untuk Kendaraan, ANL Report ANL/ESD-42, Mei 2000, hlm. 20] .
Namun, ketebalan tambahan yang diperlukan dalam separator untuk sel EV/HEV mengimbangi kekuatan yang berkurang. [Y. Nishi, dalam: M. Wakihara, O. Yamamoto (Eds.), Baterai Lithium Ion, Wiley/VCH/Kodansha, Tokyo, 1998, hlm. 195.
P.Arora, Z.Zhang, Chem. Wahyu 104 (2004) 4419].
Selain karakteristik konvensional seperti kekuatan mekanik yang baik, permeabilitas elektrolit, pemisah berpori mikro ini menampilkan sifat pelindung selama penyalahgunaan sel. Misalnya, jika suhu sel naik secara tidak normal karena overcharge yang berlebihan, misalnya, panas yang dihasilkan melunakkan PE dan menutup mikropori dalam film. Ini disebut pemisah “shutdown”. Setelah shutdown terjadi, transportasi ionik antara elektroda secara efektif dihentikan dan arus berhenti mengalir. Jika separator dapat mempertahankan integritas mekanis di atas suhu shutdownnya, separator dapat memberikan margin keamanan pada perangkat; jika tidak, elektroda dapat bersentuhan langsung, bereaksi secara kimia, menyebabkan pelarian termal.
Namun, ada kemungkinan bahwa karena inersia termal, suhu dapat terus meningkat bahkan setelah dimatikan. Dalam kondisi seperti itu, separator akan melelehkan dan memperpendek elektroda, yang menyebabkan reaksi hebat dan pembangkitan panas. Fenomena ini disebut “meltdown” atau “breakdown” separator. Oleh karena itu, untuk memastikan keamanan sel, perbedaan antara suhu “shutdown” dan “meltdown” harus sebesar mungkin.
Pemisah yang seluruhnya terbuat dari polietilen densitas tinggi meleleh pada 135 °C dan kehilangan integritas mekanis di atas suhu ini. Namun, pemisah yang dibuat dengan melaminasi lapisan polipropilena dan polietilena mempertahankan integritas mekanis setidaknya hingga 165 °C, titik leleh polipropilena. Sangat menarik untuk dicatat bahwa meskipun polietilen dengan berat molekul sangat tinggi meleleh pada 135 ° C, pemisah yang dibuat dari bahan ini mempertahankan integritas mekanisnya hingga setidaknya 180 ° C karena viskositas bahan sedemikian rupa sehingga mempertahankan integritas fisik.
Pemisah shutdown dapat diandalkan dan produsen baterai lithium-ion semakin memilih untuk memasukkannya ke dalam produk mereka. Pemisah shutdown yang paling umum memiliki polipropilen dengan berat molekul tinggi yang dicampur dengan polietilen dengan berat molekul super tinggi. Di sini, sifat pematian unik dari polietilen digabungkan dengan baik dengan integritas mekanis polipropilena yang tinggi pada suhu tinggi. Karena shutdown bersifat ireversibel, sekali diaktifkan, pemisah ini membuat sel-sel rusak secara permanen. [PG Balakrishnan, R. Ramesh, T. Prem Kumar , J. Sumber Daya. 155 (2006) 401–414]
Bahan lain dalam baterai Lithium ion
Ada bahan lain seperti kolektor arus seperti aluminium, nikel dan foil tembaga , pengikat seperti s tyrene-butadiene copolymer (SBR), dan p olyvinylidene fluoride (PVDF), elektrolit dan pelarut, aditif konduktif katoda, pemisah.
Keuntungan & Keterbatasan Baterai Lithium-ion - Pembuatan sel ion lithium
Rasio berat anoda ke katoda
Sangat penting bahwa tidak ada logam lithium yang terbentuk selama operasi sel. Deposisi logam membentuk dendrit yang secara internal memperpendek sel. Kontrol tegangan selama pengisian dan keseimbangan sel membantu mengurangi masalah ini sampai batas tertentu. Metode utama untuk mengontrol deposisi lithium adalah rasio anoda dengan kapasitas katoda dari pelat individu dalam sel. Elektroda anoda memiliki kapasitas yang dapat digunakan sekitar 10% lebih tinggi daripada katoda. Ini mencegah pengendapan logam litium pada anoda selama pengisian, karena katoda menentukan kapasitas sel. Jika logam lithium mengendap pada permukaan elektroda, ia bereaksi dengan elektrolit dan dapat memulai pelarian termal.

Gambar 21. Rasio kapasitas anoda dan katoda dalam sel ion Lithium
( Kredit: Ralph J. Brodd dan Kazuo Tagawa, dalam Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk dan Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, hlm. 272, 2002.)
Proses perakitan sel ion lithium
Proses perakitan sel untuk baterai lithium ion membutuhkan presisi dan akurasi saat melapisi stok elektroda positif dan negatif yang dilapisi dengan bahan aktif. Proses pelapisan merupakan elemen penting dalam memastikan kapasitas tinggi, produk keandalan tinggi. Jika pelapis berkualitas buruk, hanya baterai berkinerja rendah yang akan diproduksi. Langkah awal dalam persiapan massa aktif menentukan hasilnya.
Cohen dan Gutoff [E. Cohen dan E. Gutoff, Teknologi Pelapisan dan Pengeringan Modern, Wiley-VCH,
New York, 1992] menjelaskan metodologi untuk sampai pada teknik pelapisan terbaik untuk aplikasi tertentu, berdasarkan reologi bubur pelapis, presisi dan kecepatan pelapisan yang diperlukan.

Gambar 22. Proses pelapisan anoda dan katoda
( Kredit: Ralph J. Brodd dan Kazuo Tagawain in Advances in Lithium-Ion Batteries, Walter A. van Schalkwijk dan Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, hlm. 273, 2002.)
Diagram alir untuk pembuatan baterai Lithium ion

Gambar 23. BAGAN ALIRAN UNTUK PEMBUATAN SEL ION LITHIUM
[Ralph J. Brodd dan Kazuo Tagawa dalam Kemajuan Baterai Lithium-Ion, Walter A. van Schalkwijk dan Bruno Scrosati (Eds.), Penerbit Akademik Kluwer, New York, hlm. 271, 2002.]

Kredit: Electropediadia https: //www.mpoweruk.com/battery_manufacturing.htm
Gambar 24. Diagram alir pembuatan elektroda dari bahan baku
Perakitan sel ion lithium




Pabrikan baterai ion Lithium membidik poin-poin berikut saat merakit sel:
- Desain untuk sel ion Lithium harus menghasilkan kerapatan arus yang seragam di seluruh area elektroda.
- Untuk memastikan kontak yang baik antara bahan aktif (AM) dan kolektor saat ini
- Elektroda dengan luas permukaan yang besar digunakan untuk memberikan kinerja kecepatan tinggi pada sel. Hal ini mengurangi polarisasi, yaitu rugi-rugi tegangan karena kinetika reaksi elektroda dan menurunkan jatuh tegangan melintasi pemisah.
Struktur pori dan kombinasi karbon konduktif memberikan kontak antar partikel yang baik dari bahan aktif.
Kontak yang baik sangat penting antara bahan aktif, karbon konduktif dan kolektor saat ini , untuk pemanfaatan penuh bahan aktif dan untuk efisiensi yang baik selama kinerja tingkat tinggi.
Campuran katoda kobalt dibuat dari LiCoO2 (serbuk hitam) + pengikat PVdF (termoplastik fluoropolimer semi-kristal putih) + N-metil pirolidon (NMP, cairan organik tidak berwarna) sebagai pelarut. LICoO2 menjadi nonkonduktif, pengencer konduktif, selalu karbon hitam, ditambahkan untuk meningkatkan konduktivitas LiCoO2.
Rasio dan jumlah bahan ditentukan oleh desain sel dan ukuran mixer. Prosedur pencampuran intensif digunakan untuk mengeringkan campuran bahan aktif non-konduktor dan karbon sebelum menambahkan pelarut pelapis dan pengikat.
Campuran dicampur kering untuk memberikan lapisan seragam partikel bahan aktif dengan lapisan tipis karbon konduktif sehingga kontak listrik antara AM dan jaringan pengumpul arus (aluminium foil, ketebalan 20 mm) ditingkatkan, sehingga memastikan pemanfaatan penuh dari semua AM. Polimer NMP dilarutkan dalam pelarut pelapis dalam wadah terpisah. Campuran campuran kering dan larutan pelarut kemudian digabungkan untuk membentuk bubur.
Penambahan pelarut digunakan untuk mengatur viskositas bubur (atau cat) untuk operasi pelapisan . Polyvinylenedifluoride (PVdF) adalah pengikat pilihan dan pelarutnya adalah N-metilpirolidinon (NMP). Bubur dari operasi pencampuran ditempatkan dalam wadah tertutup, yang berfungsi sebagai reservoir dan media transfer untuk operasi pelapisan. Sejumlah tepat bubur pelapis dipompa dari wadah penyimpanan dengan pompa roda gigi, atau pompa presisi serupa, untuk menghindari masuknya udara dalam cairan ke kepala pelapis.
Campuran anoda disiapkan dengan cara yang sama dengan karbon keras, pengikat PVdF dan NMP. Campuran ini dilapisi pada foil tembaga yang digunakan sebagai kisi (ketebalan 10 mm).
Pelapisan dilakukan pada kedua sisi dengan ketebalan sekitar 100 mm untuk anoda dan katoda. Dengan mengurangi ketebalan lapisan, peningkatan luas permukaan total dicapai untuk volume sel tertentu. Elektrolit organik yang digunakan memiliki konduktivitas yang lebih rendah dibandingkan dengan elektrolit berair sehingga luas permukaan yang lebih tinggi ini akan memfasilitasi sel pelepasan daya tinggi.
Ketebalan elektroda tergantung pada daya maksimum yang dibutuhkan. Fitur unik dari teknologi manufaktur baterai Lithium ion adalah memungkinkan berbagai desain rasio daya/energi dengan teknologi manufaktur elektroda yang sama. [Broussely, Nazri hlm 651]. Tetapi koleksi dan tabbing saat ini yang sesuai, bentuk dan desain sel adalah penting.
Perakitan Sel: Foil yang dilapisi melewati oven untuk menguapkan pelarut dan meninggalkan jumlah massa aktif yang tepat pada foil. Banyak pelarut pelapis diklasifikasikan sebagai berbahaya dan tidak dapat dilepaskan ke atmosfer. Sebagai tindakan penghematan biaya, pelarut umumnya pulih untuk digunakan kembali dalam proses. Untuk menghindari kontaminasi lingkungan, pelarut dapat dibakar.
Sebagian besar sel ion Lithium berbentuk silinder. Gulungan jeli diratakan untuk mendapatkan elemen sel prismatik .
Sel-sel prismatik menguntungkan untuk pengisian volume yang lebih baik, tetapi bertanggung jawab untuk menggembung saat bersepeda atau menua. Kaleng sel silinder menawarkan kekuatan mekanik yang lebih baik, stabilitas dimensi yang baik dan tekanan yang seragam dalam elemen.
Operasi pelapisan menghasilkan pelapisan terputus agar sesuai dengan panjang koil. Mesin penggulung dirancang untuk beroperasi secara otomatis untuk digunakan dengan gulungan jumbo kering katoda dan anoda dan pemisah (ketebalan 25mm atau kurang, baik PP atau PE atau campuran).
Operasi dimulai dengan mengelas tab ke bagian foil yang tidak dilapisi. Mesin penggulung kemudian memotong strip dengan panjang yang tepat dan melilitkan kombinasi anoda-separator-katoda menjadi kumparan atau gelendong yang rapat dengan cara jellyroll. Saat inti luka bertambah diameternya, mesin penggulung secara otomatis mengkompensasi untuk mempertahankan tegangan konstan saat diameter kumparan bertambah untuk toleransi yang dekat pada diameter. Angin elips untuk sel prismatik adalah proses yang lebih kompleks dan lebih lambat.
Setelah belitan, koil diperiksa apakah ada korsleting internal sebelum dimasukkan ke dalam kaleng. Kaleng baja harus bersih dan berlapis nikel untuk memberikan permukaan yang stabil dan meminimalkan korosi kaleng sebelum perakitan sel. Ujung anoda dilas ke bagian bawah kaleng dan ujung katoda dilas ke lubang pengaman. Elektrolit ditambahkan ke sel setengah rakitan. Perakitan selesai dengan crimping penutup atas.
Penolakan dini kesalahan sel potensial adalah ukuran ekonomi dan mencegah lebih banyak pekerjaan pada sel yang buruk. Gelendong dimasukkan ke dalam kaleng sehingga kaleng memberikan tekanan konstan untuk menahan komponen elemen berdekatan, sehingga menghilangkan kemungkinan rongga di antara mereka. Beberapa pabrikan mungkin memasukkan mandrel untuk menstabilkan bagian tengah koil.
Kecuali semua operasi dilakukan di ruang kering atau kotak kering , air yang diserap dalam bahan aktif harus dihilangkan dengan panas dan vakum sebelum proses pengisian elektrolit.
Pengisian vakum presisi elektrolit dilakukan untuk memastikan bahwa elektrolit meresap dan sepenuhnya mengisi porositas yang tersedia di separator dan struktur elektroda. Pompa presisi mengukur volume elektrolit yang dihitung yang dibutuhkan untuk operasi sel yang baik. Selalu semua produsen menggunakan LiPF 6 (senyawa kristal putih anorganik) sebagai elektrolit dan karbonat siklik (EC, etilena karbonat) atau linier (DMC, dimetil karbonat, DEC, dietil karbonat, atau EMC, etil-metil karbonat, dll.) pelarut untuk garam elektrolit ini.
Elektrolit berdasarkan campuran pelarut etilen karbonat (EC) dengan dimetil karbonat (DMC) dan/atau dietil karbonat (DEC) biasanya digunakan untuk baterai ion litium dalam kombinasi dengan katoda “4 V” (kobalt, nikelat, dan manganat) karena sifat potensial oksidasi yang tinggi dari pelarut.
Setelah mengisi sel dengan elektrolit, sel disegel dengan kompresi terkontrol dari paking polimer atau grommet yang ditempatkan di antara kaleng sel dan pelat atas. Tekanan pada segel paking polimer dikontrol agar tetap dalam batas elastis polimer. Jika batas elastis terlampaui, aliran dingin polimer dan merusak segel.
Setiap pabrikan menggunakan konstruksi mekanis yang agak berbeda untuk menyegel sel tetapi hasil akhirnya pada dasarnya identik. Biasanya, bahu atau langkan terbentuk di dekat bagian atas sel. Ini berfungsi sebagai dasar untuk segel dan untuk menahan agar-agar pada tempatnya dan mencegah telescoping atau mengubah posisi gelendong luka di bawah pengaruh getaran dan goncangan.
Setiap pergeseran posisi menyebabkan perubahan dalam distribusi arus dan menghasilkan siklus hidup yang buruk atau pelapisan lithium pada sel berkinerja tinggi. Segel pelat atas sel berisi ventilasi, elemen koefisien suhu positif (PTC) dan perangkat keamanan interupsi arus (CID). Baik CID dan PTC adalah perangkat keamanan yang dirancang untuk mengaktifkan dan mencegah suhu dan tekanan berbahaya berkembang di dalam sel. Setiap lot perangkat diperiksa untuk pengoperasian yang benar sebelum dimasukkan ke dalam rakitan atas.
Setelah segel diterapkan, sel dapat dicuci, dilapisi dan diberi label. Mereka diberi nomor seri untuk melacak hari pembuatan dan untuk mengidentifikasi semua komponen sel (bahan elektroda, elektrolit, pemisah dan sejenisnya). Informasi tentang kapasitas dan tegangan disimpan dengan nomor sel dan digunakan kemudian untuk mencocokkan sel untuk perakitan paket.
Sel dapat dilas laser dengan segel kaca ke logam untuk memberikan segel kedap udara yang tahan lama. Dengan sel yang lebih besar, perawatan yang lebih besar harus dilakukan untuk memastikan operasi yang aman, bahkan dalam kondisi penyalahgunaan.
Sementara proses di atas, digambarkan untuk sel tertutup kecil yang digunakan dalam elektronik portabel, proses untuk baterai industri yang lebih besar untuk penyimpanan energi, ruang, dan aplikasi EV mengikuti garis besar umum yang sama.
Baterai lithium ion - Pembentukan dan penuaan
Saat dirakit, ion Li tidak didoping ke dalam karbon anoda sehingga sel tidak menunjukkan tegangan. Selama pengisian awal, sebagian ion Li dari PAM LiCoO 2 tidak didoping menjadi Li 1-x CoO 2 dan ion Litium ini didoping ke dalam anoda karbon (C y ) menjadi Li x C y . Ketika tegangan pengisian mencapai 4,1 hingga 4,2 V, nilai x sekitar 0,5. (yaitu, 50%) menunjukkan bahwa 50% Li dari LiCoO 2 telah digunakan.
Aspek lain yang perlu diperhatikan adalah bahwa bagian dari ion Lithium yang didoping tidak kembali dan tetap berada di anoda. di mana, ion Lithium x-dx tetap tanpa berkontribusi pada kapasitas. Ini adalah sekitar 10 sampai 20% lithium ireversibel, yang berarti bahwa efisiensi muatan awal adalah 80 sampai 90%. Dari siklus kedua, jumlah ireversibel tidak meningkat dan sel menunjukkan kapasitas 100% yang dirancang oleh pabrikan.
Setelah pencucian dan pelapisan, tetapi sebelum dimulainya proses pembentukan, tegangan dan impedansi semua sel dicatat untuk memilah sel yang rusak. Sel-sel kemudian diisi untuk pertama kalinya
(pengisian awal atau pengisian formasi). Kondisi muatan pertama penting karena setidaknya dua alasan:
1) lapisan interfase elektrolit padat (SEI) terbentuk pada anoda untuk melindunginya dari reaksi spontan dengan elektrolit selama operasi sel normal, dan 2) membentuk kontak listrik yang baik antara bahan aktif dan elektrolit. Pengisian pertama mengikuti prosedur yang direkomendasikan pabrikan untuk mengisi daya sel tetapi sering kali dimulai pada arus yang lebih rendah dan kemudian meningkat ke arus pengisian normal sekitar sepertiga dari periode pengisian. Sel dapat melanjutkan siklus dalam batas tegangan untuk pengisian dan pengosongan untuk satu atau dua siklus lagi setelah pembentukan.
Setelah pembentukan atau siklus, tegangan dan kapasitas sel diukur dan disimpan untuk digunakan nanti dalam proses pemilihan sel . Periode penuaan bervariasi antara dua minggu dan satu bulan, tergantung pada produsen. Tegangan sel diukur lagi setelah penyimpanan. Perbedaan tegangan pada awal dan akhir periode penyimpanan digunakan untuk memilah sel dengan celana pendek “lunak” atau “mikro-“. Sel dengan korsleting internal akan memiliki tegangan yang lebih rendah setelah penyimpanan dan memisahkan diri dari distribusi tegangan dan kapasitas normal. Mungkin perlu untuk mengevakuasi sel yang lebih besar setelah pembentukan untuk menghilangkan gas formasi.
Untuk penjelasan rinci tentang proses perakitan, pembaca dirujuk ke
- Kaoru Nakajima dan Yoshio Nishi Bab 5 dalam: Sistem Penyimpanan Energi untuk Elektronik, Ed Tetsuya Osaka dan Madhav Datta, Gordon and Reach Science Publishers, Amsterdam, 2000.
- Proses Produksi Sel Lithium-Ion, Ralph J. Brodd dan Kazuo Tagawa, Bab 9 dalam: Kemajuan dalam Baterai Lithium-Ion, Walter A. van Schalkwijk dan Bruno Scrosati (Eds), Kluwer Academic Publishers, New York, hlm. 273, 2002 .
- Baterai Lithium, Sains dan Teknologi, ed. oleh GA Nazri dan G. Pistoia, Springer, New York, 2009.
- Baterai Lithium-Ion, Reiner Korthauer (ed) (2018), Diterjemahkan oleh Michael Wuest et.al., Springer, 2018.
- Kazuo Tagawa dan Ralph J. Brodd, Proses Produksi untuk Fabrikasi Baterai Lithium-Ion di Baterai Lithium-Ion, Yoshio M., Brodd RJ, Kozawa A. (eds) Springer, New York, NY. https: //doi.org/10.1007/978-0-387-34445-4_8]
- Zhang Z., Ramadass P. (2012) Sistem dan Teknologi Baterai Lithium-Ion. Dalam: Meyers RA (ed) Encyclopaedia of Sustainability Science and Technology. Springer, New York. https: //doi.org/10.1007/978-1-4419-0851-3_663
- Buku Pegangan Kimia Desain Kemasan Baterai Lithium-Ion, Komponen, Jenis dan Terminologi, John Warner, Elsevier, 2018




