Introduction aux piles à l'état solide
Dans une batterie, les ions positifs se déplacent entre les électrodes négative et positive via un conducteur d’ions et délivrent des électrons pour générer un courant électrique. Dans les batteries classiques, par exemple les batteries lithium-ion, le conducteur ionique est un composé organique liquide hautement combustible, ce qui constitue un inconvénient important. Divers processus de recherche et de développement ont permis de synthétiser une variété de composés afin de trouver des conducteurs solides performants pour remplacer les conducteurs liquides. Des chercheurs ont découvert un conducteur ionique à l’état solide dont les performances dépassent celles d’un conducteur lithium-ion classique. ex : Électrolyte solide de sulfure LGPS (LGPS : lithium, germanium, phosphore, soufre)
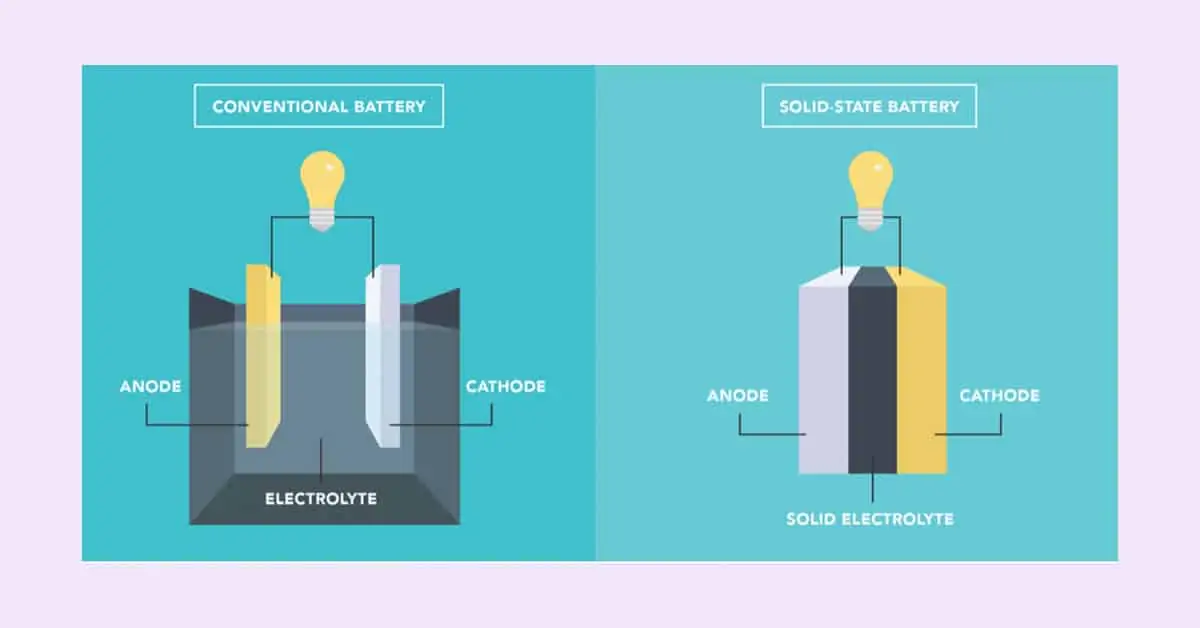
Qu’est-ce qu’une batterie à l’état solide ? Il s’agit de l’approche technologique qui présente un potentiel plus élevé en termes de sécurité, de densité énergétique et de rentabilité. Les batteries à semi-conducteurs représentent l’avenir de la technologie des batteries dans l’électronique grand public et les véhicules électriques. La cathode, l’anode, le séparateur et l’électrolyte constituent une batterie lithium-ion. La solution d’électrolyte liquide est utilisée dans les batteries à l’état liquide (batteries lithium-ion), qui sont appliquées dans les smartphones, les outils électriques et les véhicules électriques. Une batterie à l’état solide, quant à elle, utilise un électrolyte solide plutôt qu’un électrolyte liquide comme dans les batteries classiques.
L’électrolyte d’une batterie est un mélange chimique conducteur qui permet au courant de passer entre l’anode et la cathode. Les séparateurs évitent un court-circuit. Les piles à l’état solide sont des cellules électrochimiques avec une anode, une cathode et un électrolyte, comme toute autre pile. Les électrodes et les électrolytes sont solides, contrairement aux batteries au plomb.
La batterie Li-ion disponible dans le commerce possède un séparateur qui maintient la cathode et l’anode séparées par une solution d’électrolyte liquide. Les batteries à l’état solide, quant à elles, utilisent des électrolytes solides plutôt qu’une solution d’électrolyte liquide, et l’électrolyte solide joue également le rôle de séparateur. Ces batteries sont essentielles et fortement nécessaires pour augmenter la capacité des batteries solides des véhicules électriques. Ils sont inflammables, et les risques d’explosion sont négligeables. Un exemple de batterie à l’état solide est le verre au phosphate de lithium. La densité énergétique est élevée dans ces batteries.
La capacité énergétique d’une batterie à l’état solide est supérieure à celle d’une batterie Li-ion avec une solution d’électrolyte liquide. Comme il n’y a aucun risque d’explosion ou d’incendie, il n’y a pas besoin de composants de sécurité, ce qui permet de gagner de la place. Les batteries peuvent contenir deux fois plus d’énergie que les batteries lithium-ion, ce qui augmente leur puissance. Étant donné qu’il ne faut que quelques piles, une batterie à l’état solide peut augmenter la densité d’énergie par unité de surface.
Technologie des batteries à l’état solide
La SSB se concentre principalement sur les caractéristiques suivantes :
Densité énergétique plus élevée :
- Coût réduit : utilisation de matériaux moins chers et de procédés rentables et grâce à une densité énergétique élevée.
- Sécurité accrue : tolérance à la surcharge, tolérance à la charge profonde.
- Une moindre dépendance vis-à-vis des matériaux rares : moins de dépendance géologique, substitution de matériaux comme le lithium, le cobalt.
- Impact environnemental réduit : pas de matériaux toxiques, pas de métaux lourds, pas de produits chimiques dangereux, production respectueuse de l’environnement, matériaux faciles à éliminer ou à recycler.
- Autres : capacité de décharge profonde, charge rapide ou capacité de décharge.
L’électrolyte à l’état solide est le composant clé des batteries à l’état solide. Il existe trois principaux types de matériaux d’électrolyte à l’état solide.
Matériaux inorganiques : matériaux inorganiques cristallins, matériaux inorganiques amorphes. Étant donné que les électrolytes inorganiques présentent des modules élastiques élevés, une forte stabilité thermique/chimique, une large fenêtre électrochimique, une conductivité ionique élevée et une faible conductivité électronique, ces électrolytes sont mieux adaptés à la conception de batteries rigides pouvant fonctionner dans des environnements difficiles.
Polymères solides : ex : oxyde de polyéthylène. Bien que les électrolytes polymères possèdent une conductivité ionique inférieure à celle des électrolytes solides inorganiques, ils peuvent offrir une variété de géométries, une grande flexibilité, et nécessitent un traitement de production peu coûteux et simplifié. Lors de l’intégration de cellules de batteries, l’électrolyte polymère solide peut facilement créer une liaison électrode-électrolyte efficace, ce qui pourrait augmenter la stabilité électrochimique et la durée de vie des batteries. Un électrolyte liquide est utilisé dans les batteries lithium-ion traditionnelles, et il établit généralement un bon contact avec les électrodes.
Les électrodes absorbent le liquide comme une éponge grâce à leurs surfaces texturées, ce qui permet d’obtenir une grande surface de contact. En théorie, il est impossible de relier deux solides de manière transparente. Par conséquent, la résistance entre les électrodes et l’électrolyte est élevée. L’électrolyte solide sert de support stable aux électrodes de phosphate, qui sont sérigraphiées sur les deux faces. La nouvelle batterie à l’état solide, contrairement aux batteries lithium-ion traditionnelles, est entièrement exempte de substances toxiques ou dangereuses.
Les matériaux inorganiques et polymères sont combinés pour tirer parti des avantages des deux types de matériaux. Ces électrolytes présentent une conductivité ionique élevée et sont relativement flexibles.
Les propriétés mécaniques, électriques et chimiques de l’électrolyte solide, ainsi que leurs interfaces/interphases avec les électrodes de l’anode et de la cathode, ont un impact significatif sur l’efficacité de la batterie à l’état solide.
Les questions de base des batteries à l’état solide, avec un accent sur trois phénomènes essentiels :
(i) les principes de production de conducteurs ioniques avancés,
(ii) la progression structurelle aux interfaces électrolyte-électrode chimiquement instables, et
(iii) les implications du traitement des batteries à l’état solide, y compris l’architecture des électrodes et des électrolytes. Les électrolytes à l’état solide (ESS) peuvent non seulement résoudre les problèmes de sécurité, mais aussi permettre l’utilisation d’une anode métallique et le fonctionnement à haute tension.
La batterie à l’état solide (SSB) est l’une des meilleures solutions pour la prochaine génération de batteries, car les électrolytes solides ont une stabilité thermique beaucoup plus élevée. En outre, les électrolytes solides inorganiques peuvent fonctionner à des températures extrêmes, telles que celles allant de 50 à 200°C ou même plus, où les électrolytes organiques échouent en raison du gel, de l’ébullition ou de la décomposition.
Pour obtenir le rendement électrochimique attendu lors de l’utilisation d’électrolytes à l’état solide, quatre caractéristiques uniques sont prises en compte. Ces caractéristiques sont les suivantes :
( i )conductivité ionique élevée (+Li > 104 S/cm) ;
(ii) une résistance mécanique adéquate et peu de défauts structurels pour empêcher la pénétration des dendrites de lithium ;
(iii) des matières premières peu coûteuses et des procédés de préparation faciles ; et
(iv) la faible énergie d’activation pour la diffusion des ions lithium.
Avantages de la batterie à semi-conducteurs
- Structure simple : les électrolytes solides agissent comme un séparateur empêchant le contact de l’anode et de la cathode, ce qui permet d’obtenir une densité énergétique plus élevée et d’éviter le coût du séparateur.
- Haute tension : la décomposition des électrolytes solides est élevée, ce qui entraîne une forte densité d’énergie.
- Électrolyte solide ininflammable.
- L’électrolyte est ignifuge.
- Aucun risque de fuite d’électrolyte liquide.
- Peut être utilisé à des températures de fonctionnement plus élevées, ce qui permet d’élargir la plage de températures de fonctionnement.
- Possibilité d’empiler les cellules dans un seul emballage.
- La structure simple des cellules et les coûts de fabrication réduits rendent la batterie à l’état solide rentable.
- Les batteries à l’état solide se chargent 6 fois plus vite que les batteries à l’état liquide.
- La durée de vie d’une batterie à semi-conducteurs peut atteindre 10 ans.

Inconvénients de la batterie à semi-conducteurs
- Les dendrites sont le problème le plus grave des batteries à semi-conducteurs, en dehors du coût. La dendrite est une cristallisation du lithium métal qui commence à l’anode et peut s’étendre à toute la batterie. Cela se produit lorsque les ions de l’électrolyte solide se joignent aux électrons pour créer une feuille de lithium métallique solide en raison de la charge et de la décharge à fort courant.
- Ces batteries ne sont pas très utilisées dans l’électronique grand public et les véhicules électriques car elles sont très coûteuses. Les batteries à l’état solide présentent une cinétique plus lente en raison de :
- Faible conductivité ionique
- Résistance interfaciale élevée
- Mauvais contact interfacial
Comment fonctionne une batterie à l’état solide ?
Comme indiqué précédemment, les batteries à l’état solide utilisent une membrane d’électrolyte solide avec des matériaux d’électrode positive et négative solides. Pendant la charge ou la décharge, les ions migrent dans une matrice solide conductrice d’ions plutôt que dans un sel ionique dissous dans une solution, ce qui provoque les réactions de charge ou de décharge. Les réactions d’oxydoréduction sont utilisées pour stocker et distribuer l’énergie dans les batteries à l’état solide. L’anode subit une oxydation, tandis que la cathode subit une réduction. La batterie peut utiliser ce phénomène pour stocker (charge) et libérer (décharge) de l’énergie selon les besoins.
Lors de la décharge de l’énergie, les ions provoquent une réaction chimique entre les matériaux de la batterie appelée « oxydoréduction ». L’oxydation se produit à l’anode pour créer des composés avec des électrons libres, qui fournissent de l’énergie électrique, et la réduction se produit à la cathode pour créer des composés qui gagnent des électrons et préservent donc l’énergie. Le mécanisme est inversé lorsqu’une batterie est chargée. Les ions chargés positivement traversent l’électrolyte de l’électrode négative (anode) à l’électrode positive (cathode) lors de la décharge des piles solides (cathode). Une charge positive se développe alors dans la cathode et absorbe les électrons de l’anode.
Cependant, comme les électrons ne peuvent pas traverser l’électrolyte, ils doivent passer par un circuit qui fournit de l’énergie à ce à quoi il est relié, comme un moteur électrique. Au cours du processus de charge, les ions migrent vers l’anode, accumulant une charge qui absorbe les électrons de la cathode à travers un circuit. La batterie est considérée comme complètement chargée lorsque plus aucun ion ne peut circuler vers l’électrode négative. Les piles à l’état solide nécessitent différents additifs et liants à l’intérieur de leurs couches pour conserver une conductivité élevée pendant les cycles. Les matériaux doivent également être maintenus sous pression afin de maintenir le contact pendant les périodes de charge et de décharge. La dilatation et la contraction normales des matériaux pendant les cycles de chargement et de déchargement ajoutent aux difficultés de maintenir un toucher ferme.
La durée de vie et le rendement de la cellule peuvent être altérés si l’expansion et la contraction affaiblissent la liaison au fil du temps. Les batteries à semi-conducteurs simplifient également le niveau du pack, où les cellules individuelles sont fixées, par rapport aux batteries Li-ion. Les batteries à l’état solide n’ont pas besoin de beaucoup de contrôle thermique, car leur efficacité augmente avec la température.
Les taux de charge et de décharge globaux, ainsi que la conductivité ionique des électrolytes solides, augmentent avec la température. Par conséquent, la température de fonctionnement ultime d’une pile à l’état solide n’est limitée que par le point de fusion du lithium, qui est de 180°C. De plus, l’absence d’un électrolyte liquide Li-ion inflammable élimine les problèmes de conception liés à la défaillance catastrophique de la cellule ou du pack. Les batteries solides à base de lithium métal devraient être utilisées comme alternatives aux batteries Li-ion car l’anode en graphite utilisée dans les batteries Li-ion typiques a un faible potentiel par rapport au lithium (0,20 V), offrant une plus grande densité d’énergie volumétrique à tension et performances équivalentes.
Des batteries à semi-conducteurs sont-elles disponibles ?
Les stimulateurs cardiaques, la RFID et les appareils portables utilisent des piles à semi-conducteurs. Certaines de ces batteries sont utilisées dans des applications spatiales. Approches de la commercialisation des batteries à l’état solide sur le marché automobile des VE/HEV. Pour mettre au point des batteries à l’état solide, il ne suffit pas de développer un électrolyte à l’état solide approprié, il faut aussi prendre en considération des caractéristiques telles que :
- Assurer l’approvisionnement en matériel et les ventes.
- Équipement et développement pour la fabrication de cellules et de packs.
Malgré des années de développement, de nombreux acteurs n’ont pas réussi à mettre sur le marché des batteries à l’état solide. À température ambiante, les électrolytes ioniques sont généralement inférieurs de plusieurs ordres de grandeur à ceux des électrolytes liquides. C’est l’un des principaux obstacles à la commercialisation des batteries à l’état solide. Si le concept des batteries à semi-conducteurs existe depuis des décennies, ce n’est que maintenant que des progrès sont réalisés, grâce aux investissements des entreprises d’électronique, des constructeurs automobiles et des fournisseurs industriels généraux.
Pourquoi les piles à semi-conducteurs sont-elles meilleures ?
Les batteries à l’état solide offrent plusieurs avantages par rapport à leurs homologues remplies de liquide, notamment une plus grande autonomie, des temps de charge plus rapides et une expérience plus fluide. Au lieu de suspendre les électrodes dans un électrolyte liquide, les batteries à l’état solide compriment l’anode, la cathode et l’électrolyte en trois couches plates. Par conséquent, il est possible de les rendre plus petites – ou du moins de les accentuer – tout en transportant la même quantité d’énergie qu’une batterie à solvant plus grande.
Ainsi, lorsqu’un téléphone ou un ordinateur portable est équipé d’une batterie au lithium-ion ou au lithium-polymère et d’une batterie à semi-conducteurs de même capacité, il durera beaucoup plus longtemps. On crée un système qui transporte la même quantité de charge mais qui est beaucoup plus petit et plus fin. Les batteries à l’état solide, lorsqu’elles sont utilisées pour alimenter des appareils électriques ou même des véhicules électriques, peuvent se recharger beaucoup plus rapidement car les ions peuvent se déplacer de la cathode à l’anode beaucoup plus rapidement. Une batterie à l’état solide pourrait surpasser les différentes batteries rechargeables en termes de capacité de 500 % ou plus et se charger en un dixième du temps. Les piles à l’état solide sont moins nocives pour l’environnement.
Les piles solides à couches minces sont moins dangereuses pour l’environnement que les piles classiques. Comme les batteries à semi-conducteurs ont des performances et une densité d’énergie plus élevées, elles n’ont pas besoin des composants de refroidissement et de contrôle des batteries lithium-ion, ce qui permet de réduire la taille globale, d’accroître la liberté des dispositifs et de diminuer le poids.
Étant donné que les batteries à l’état solide sont résistantes à la corrosion des électrodes causée par les produits chimiques présents dans l’électrolyte liquide ou à l’accumulation de couches solides dans l’électrolyte qui réduit la durée de vie de la batterie, les batteries à l’état solide peuvent supporter davantage de cycles de décharge et de charge que les batteries au lithium-ion. Les batteries à semi-conducteurs peuvent être rechargées jusqu’à sept fois plus que les batteries au lithium-ion, ce qui leur permet de durer dix ans au lieu des quelques années prévues pour les batteries au lithium-ion. Les établissements d’enseignement, les fabricants de batteries et les experts en matériaux étudient tous la possibilité de transformer les batteries à l’état solide en sources d’énergie de nouvelle génération pour une utilisation généralisée.
Les batteries à l’état solide se chargent-elles plus rapidement ?
Certains électrolytes solides ont des conductivités ioniques supérieures à 5 mS/cm et sont des conducteurs mono-ioniques. En cas de courant élevé, cela empêche la résistance de polarisation de s’accumuler dans l’électrolyte solide. Par conséquent, la recharge rapide est potentiellement réalisable. Les batteries à l’état solide utilisent un matériau solide, généralement un polymère ou un composé céramique, pour remplacer l’électrolyte liquide inflammable des batteries lithium-ion. Les anodes en lithium-métal ont été introduites pour remplacer les anodes traditionnelles en graphite ou en silicium. Cet effort de développement de batteries lithium-métal à l’état solide a le potentiel de doubler la densité énergétique tout en réduisant considérablement le temps de charge.
Comment fabrique-t-on une batterie à l’état solide ?
Dans une batterie à l’état solide, il n’y a que deux couches principales, la cathode, une électrode positive avec un contact électrique avec un séparateur en céramique à l’état solide qui remplace le séparateur en polymère, qui remplace le séparateur en polymère poreux que l’on trouve dans les batteries lithium-ion classiques. Les électrolytes à l’état solide reposent sur des conducteurs superioniques et des interfaces optimisées.
Le défi à relever pour développer un bon électrolyte à l’état solide est de surmonter les limites de l’interface et de la triple phase où les électrodes positives, les ions et les électrons doivent être transportés simultanément, ce qui nécessite une phase très intermittente. Réaliser le transport simultané d’électrons et d’ions à l’interface et le contrôle des interfaces est un défi.
Les problèmes de stabilité chimique avec un électrolyte positif et de stabilité oxydative de l’électrolyte en présence de carbone et les problèmes de dendrites d’ions métalliques nécessitent l’incorporation d’interfaces protégées. Les électrolytes solides ont une conductivité ionique inférieure à celle des électrolytes liquides d’un ordre de grandeur. Il est également essentiel d’optimiser la résistance à l’interface électrolyte-électrode.
Les défis d’un électrolyte solide pour les batteries :
Electrodes positives composites épaisses à masse active élevée : conductivité ionique élevée des électrolytes à l’état solide. Interface stable avec l’oxyde et faible activité redox avec des additifs conducteurs électroniques.
Les membranes minces à électrolyte solide de faible masse doivent posséder de bonnes propriétés mécaniques, une bonne ductilité et un bon contrôle de la pression dynamique.
Tous les électrolytes SSB offrent une combinaison sans précédent de conductivité ionique élevée et d’excellente stabilité entre l’anode et la cathode. La compatibilité de l’anode en est la clé, car elle apporte un avantage essentiel au niveau de la cellule par rapport aux autres batteries lithium-ion classiques.
Il existe trois principaux électrolytes solides :
Électrolyte polymère: l’avantage de l’électrolyte polymère est la facilité de traitement des cellules. Les inconvénients sont une stabilité relativement faible vis-à-vis du métal et une conductivité relativement faible à des températures particulièrement basses.
Conductivité ionique plus faible = transport d’ions plus faible = moins de puissance.
Électrolyte d’oxyde : ils possèdent des propriétés mécaniques idéales, sont très rigides et sont chimiquement stables par rapport à l’anode métallique. Parmi les principaux inconvénients, citons leur faible capacité à être corrodés rapidement à l’aide d’un électrolyte à base d’oxyde et leur difficulté à être traités car ils nécessitent des températures très élevées. Ils possèdent une stabilité thermique supérieure, une aptitude au traitement cellulaire négligeable, une sensibilité à l’humidité et une conductivité modérée. Les électrolytes à base d’oxyde sont normalement chimiquement stables et peuvent être utilisés avec des matériaux cathodiques à haute énergie.
La conductivité ionique est toutefois inférieure à celle des électrolytes à base de sulfure.
Matériaux avec une pérovskite (LLTO : Lithium Lanthanum Titanium Oxide)
La structure Garnet (LLZO, lithium lanthanum zirconium oxide), ainsi que NASICON (LAGP : Lithium Aluminum Germanium Phosphate), sont impressionnants parmi les électrolytes à base d’oxydes.
Électrolyte sulfuré : ils possèdent des propriétés mécaniques se situant entre ce polymère et un oxyde. Ils sont les plus conducteurs de toutes les classes d’électrolytes. Tous les électrolytes qui battent des records proviennent de matériaux de la classe des sulfures. Ils possèdent une conductivité plus élevée, une meilleure aptitude au traitement cellulaire et une meilleure capacité thermique, mais sont sensibles à l’humidité. La conductivité ionique est normalement plus élevée dans les électrolytes à base de sulfure, mais ils sont plus instables chimiquement.
À température ambiante, le sulfure de lithium-étain-phosphore amorphe (LSPS) présente une conductivité ionique très élevée. En revanche, les incompatibilités avec le lithium métal sont préoccupantes.
Un matériau qui détermine les électrolytes est connu sous le nom d’additif. Un additif est une petite quantité d’un matériau qui forme un revêtement protecteur sur les surfaces de la cathode et de l’anode. Il empêche la dégradation de la batterie en facilitant le passage des ions lithium entre la cathode et l’anode.
Les additifs cathodiques et anodiques sont les deux types d’additifs. Les additifs de cathode empêchent le vieillissement de la batterie en stabilisant la structure de la cathode et en protégeant la surface, ce qui élimine la surchauffe et la surcharge. Les additifs d’anode se dissolvent plus rapidement qu’un solvant, formant un film solide dans l’anode qui prolonge sa durée de vie, empêche la surchauffe et maintient la batterie chargée. Les additifs jouent un rôle important dans l’ensemble du système en prolongeant sa durée de vie, en améliorant les problèmes liés aux hautes températures et en réduisant la résistance.
Un séparateur est une fine membrane isolante d’environ quatre caractéristiques qui maintient la cathode et l’anode séparées. Deuxièmement, comme son nom l’indique, le séparateur protège la cathode et l’anode contre tout contact à l’intérieur de la batterie.
Deuxièmement, les séparateurs ont des pores de taille submicronique, invisibles à l’œil nu, et les pores servent de canaux pour le passage des ions de lithium entre la cathode et l’anode. Comme les séparateurs ont une bonne stabilité mécanique, la propriété de traction empêche les sous-produits et les substances étrangères d’entrer, ce qui garantit la sécurité. Les matériaux électrochimiquement stables et à forte isolation peuvent être utilisés comme séparateurs. Les séparateurs sont censés éviter l’interaction entre la cathode et l’anode, et cela entraîne des problèmes majeurs s’ils interfèrent avec les ions lithium ou d’autres ions dans une batterie. Les séparateurs doivent être capables d’assurer la protection en fermant les pores et en empêchant le mouvement des ions si la température d’une batterie dépasse une certaine limite.
Enfin, les séparateurs SSB devraient être suffisamment petits pour permettre d’incorporer davantage de matériaux actifs dans une batterie, ce qui augmenterait la densité énergétique. Pour éviter les dommages et assurer la protection, ils doivent également avoir une puissance mécanique élevée.
Exigences relatives à l’électrolyte solide
Des électrolytes solides présentant une combinaison spécifique de propriétés seront nécessaires pour la commercialisation des batteries à l’état solide. Pour être un substitut d’électrolyte liquide approprié, les électrolytes solides doivent avoir une conductivité ionique du lithium supérieure à 0,1 mS/cm. Soit l’électrolyte doit être chimiquement stable à la réduction du lithium, soit une couche de réaction passivante doit être formée. Pour maintenir la résistance interne des cellules à un faible niveau, l’électrolyte doit former des interfaces à faible résistance.
À l’interface des métaux alcalins, où les couches de substrat ayant réagi à l’atmosphère, les oxydes réduits et le mouillage inhomogène peuvent tous conduire à une résistance d’interface substantielle, la création d’interfaces à faible résistance ajoute de la complexité. l’électrolyte doit avoir une résistance et une ténacité suffisantes pour éviter la dissémination des filaments de lithium dans l’électrolyte. Aux potentiels anodique et cathodique, l’électrolyte doit être stable.
Formes d’électrolyte solide
Les électrolytes solides polymères ayant une faible conductivité ionique, ils sont généralement utilisés à des températures plus élevées (60°C-80°C) pour bénéficier d’un transport ionique plus important. Bien que les polymères soient simples à travailler, leurs propriétés mécaniques sont insuffisantes pour maintenir la stabilité de l’anode de lithium métallique.
En conséquence, les électrolytes solides inorganiques ont reçu la plus grande reconnaissance. Les conductivités des électrolytes solides de sulfure sont parmi les plus fortes de tous les électrolytes solides.
Bien qu’il existe de nombreuses chimies, le système Li2 S-P2 S5 est le plus utilisé. Dans le cadre du Li2 S-P2 S5, les électrolytes peuvent être vitreux, cristallins ou partiellement cristallins. Les électrolytes Li2 S-P2 S5 non dopés présentent une faible stabilité électrochimique avec le lithium, tandis que les versions dopées présentent une meilleure stabilité. À température ambiante ou en dessous de 400°C, la nature ductile des électrolytes sulfurés leur permet de se comprimer en compacts avec un bon pontage électrochimique entre les particules. Par conséquent, les électrolytes sulfurés sont les électrolytes solides inorganiques les plus faciles à traiter.
Cependant, la réactivité avec la vapeur d’eau présente dans l’air peut constituer un problème avec certaines compositions d’électrolytes sulfurés, libérant du H2 S et dégradant l’électrolyte. Par conséquent, ils sont normalement traités dans des environnements d’argon ou de chambre sèche à faible humidité.
Les électrolytes solides à base d’oxyde sont une deuxième forme d’électrolyte solide inorganique. Il existe quelques formes différentes, mais le grenat Li7 La3 Zr2 O12 est le plus courant. À température ambiante, les électrolytes à oxyde solide présentent de fortes conductivités ioniques, la gamme électrochimique la plus large et la stabilité chimique maximale vis-à-vis du lithium. En outre, les matériaux à base d’oxyde présentent les modules élastiques et la résistance à la rupture les plus élevés de tous les électrolytes solides, ce qui les rend idéaux pour la stabilité physique de l’anode de lithium métal et la durée de vie des cellules à long terme. Bien qu’ils présentent le meilleur mélange de propriétés électrochimiques, les électrolytes denses à haute conductivité ionique nécessitent des températures de frittage de 1 000°C à 1 300°C.
La résistance au développement de dendrites ou de filaments de lithium dans les électrolytes solides tend à être liée à la densité de courant ou au courant total de la cellule divisé par la section transversale de l’électrolyte. Par conséquent, la cellule peut tomber en panne à une densité de courant critique (DCC) lorsque le lithium métallique pénètre dans la cellule. Une charge stable est possible à des densités de courant inférieures à cette valeur critique. Le dépôt à courant constant de lithium dans des cellules asymétriques avec des électrodes de lithium de part et d’autre d’un électrolyte solide est un examen standard du DCC.
Lors de la préparation de l’électrolyte solide de sulfure de LGPS, la structure du matériau a été analysée avec des faisceaux de neutrons. Les chercheurs ont pu observer le mouvement linéaire des ions à l’intérieur de la structure moléculaire du conducteur solide. Un tunnel est observé dans sa structure 3D. Le mouvement des ions lithium a été observé dans ce tunnel. Grâce à cet indice, les chercheurs ont pu améliorer la conductivité ionique et la stabilité du matériau, et développer deux nouveaux matériaux en ajoutant une petite quantité de chlore au LGPS. Ces matériaux présentaient les performances de conducteur ionique les plus élevées au monde.
Ces matériaux ont été analysés avec un diffractomètre de conception des matériaux. Les résultats ont montré une structure innovante qui permet aux ions de se déplacer en trois dimensions plutôt qu’en une seule. C’est ce qui a rendu possible la plus haute performance des matériaux. Parmi une large gamme de cellules de nouvelle génération qui ont été développées, ces matériaux sont devenus des électrolytes puissants à utiliser dans tous les SSB.
Ces SSB ont une densité énergétique et une puissance de sortie légèrement supérieures à celles des batteries lithium-ion. Ainsi, les mérites de tous les SSB sont conçus pour avoir des batteries compactes et de grande capacité qui peuvent être rechargées en peu de temps. En tant que produit de la recherche dédiée et du niveau d’analyse atomique des matériaux d’électrolyte, ces nouveaux SSB pourraient conduire à une nouvelle génération de batteries.
Dans une batterie solide à ions lithium, lorsque la batterie se charge, le lithium quitte le voyage à travers le réseau atomique d’un séparateur céramique solide non poreux. Une fois que le lithium est vraiment séparé, il se dépose entre le séparateur et le contact électrique, formant une anode de lithium métallique pur. L’anode en lithium métal permet de stocker l’énergie d’une batterie à l’état solide dans un plus petit volume d’énergie, ce qui permet une densité d’énergie plus élevée par rapport aux batteries lithium-ion classiques. Les batteries lithium-métal à l’état solide permettent une plus grande autonomie grâce à la densité énergétique plus élevée de la charge rapide de quinze minutes et un fonctionnement plus sûr en éliminant le séparateur polymère organique.
Batterie lithium-ion haute énergie :
- Utilisation de matériaux à haute énergie
- Les cathodes NMC ou NCA riches en nickel, lorsqu’elles sont associées à une anode composite en silicium, offrent des densités énergétiques gravimétriques et volumétriques plus élevées.
- Des réductions de coûts sont prévues pour la fabrication.
- Seules des modifications mineures du processus de production sont nécessaires.
Batterie solide au lithium
Batterie au lithium-soufre :
- Lors de la décharge, le lithium réagit avec le soufre à la cathode pour former des sulfures de lithium.
- Le soufre, en tant que matériau répandu et rentable, offre des cellules de batterie à faible coût.
- L’incertitude concernant le cycle et la durée de vie, ainsi qu’une sensibilité aux hautes températures, continuent de contrecarrer la croissance du segment de marché.
- Actuellement, la densité énergétique volumétrique tend à être trop faible pour une utilisation automobile.

Batterie lithium-air :
- Le lithium est oxydé par l’oxygène du côté de la cathode lors de la décharge, ce qui donne du peroxyde de lithium et de l’oxyde de lithium.
- La haute densité énergétique et l’utilisation de l’air ambiant sont techniquement réalisables.
- D’énormes obstacles dans la stabilité du cycle, ce qui rend improbable une application automobile dans la prochaine décennie.
Fonctionnalité et conception de toutes les SSB
- Un électrolyte solide perméable aux ions agit comme un séparateur et assure la séparation spatiale et électrique entre la cathode et l’anode d’un SSB tout entier.
- Il existe une grande variété de modèles de cellules parmi lesquelles vous pouvez choisir. Une cellule à couche mince est représentée dans le schéma ci-dessus. Une cathode composite peut être utilisée pour créer des couches plus épaisses.
- Les ions de lithium passent de l’anode à la cathode en passant par l’électrolyte solide lorsqu’un SSB est déchargé. Une puissance circule en même temps sur la charge externe.
- La résistance à l’interface anode-électrolyte est un facteur critique pour l’efficacité de la cellule de la batterie. Une feuille externe, telle qu’un caoutchouc ou un alliage d’aluminium, peut être utilisée pour atténuer ce phénomène.
- L’empilement bipolaire est possible grâce à l’électrolyte fort. Par conséquent, les cellules élémentaires sont connectées en série.
De quoi sont faites les batteries à l'état solide ?
Matériaux de batteries à l’état solide :
Anode :
En raison de leur potentiel théorique pour atteindre la densité énergétique maximale, les anodes en lithium métal sont considérées comme idéales. L’électrolyte fort, quant à lui, doit empêcher le lithium métallique de former des dendrites. De plus, comme le lithium forme une couche passive avec l’oxygène atmosphérique, une manipulation sous atmosphère inerte est nécessaire.
Le silicium utilisé comme matériau d’anode offre des densités d’énergie très élevées, mais il subit de nombreux changements de volume lorsqu’il est mélangé au lithium.
Cathode :
L’oxyde métallique est utilisé comme cathode. Comme il y a beaucoup moins de matériaux qui ont été spécifiquement conçus pour le tout BLU, les matériaux de cathode existants sont utilisés dans la plupart des cas.
En principe, une grande variété de matériaux cathodiques éprouvés peuvent être utilisés, en fonction de l’électrolyte, allant de matériaux peu coûteux et sûrs comme le phosphate de fer lithié (LFP) à l’oxyde de nickel manganèse cobalt lithium (NMC). Seuls l’oxyde de cobalt et de lithium (LCO) comme matériau cathodique et le LLZO comme électrolyte font preuve d’une stabilité et d’une efficacité adéquates dans la pratique.
Procédé de fabrication de toutes les batteries à l'état solide
- Le traitement des électrodes et de l’électrolyte, l’assemblage des cellules et la finition des cellules sont les trois principales étapes de la production d’un SSB.
- Il n’y a pas de chaîne de processus universellement vraie ; au contraire, un grand nombre de chaînes de processus possibles peuvent être utilisées. Ceux-ci diffèrent du processus de production des batteries lithium-ion à plusieurs égards.
- Cette méthode compare et oppose deux choix de procédés différents, principalement en termes de rendement des électrodes et de l’électrolyte.
Electrode et électrolyte
Production —- assemblage de cellules—— finition de cellules
Processus A
Processus B
La synthèse de cellules tranchées avec des électrolytes solides inorganiques fait l’objet des deux options de procédé. Pour les batteries entièrement à l’état solide, le format de cellule de poche est généralement le plus approprié.
Une cellule prismatique ou ronde :
En raison des composants solides d’une batterie entièrement solide, les enroulements sont confrontés à des défis majeurs. Les couches de céramique qui sont fragiles peuvent développer des fissures. En outre, le problème de la bonne adhésion des couches n’a pas encore été résolu.
Cellule de poche :
Les piles tout-solides bénéficient de l’empilement car les couches plates ne sont pas déformées. De plus, le composé de la couche est produit pendant le traitement de l’électrode et de l’électrolyte, ne laissant que les cellules de base à empiler ultérieurement.
Une pièce sèche est nécessaire pour le processus de fabrication en raison de la réactivité des matériaux à l’atmosphère. Lorsque vous travaillez avec du lithium métallique, il est recommandé d’utiliser un gaz inerte, tel que l’argon.
Une évaluation complète de l’applicabilité des compétences acquises dans le développement de cellules de batteries lithium-ion est effectuée pour chaque étape du processus.
Production d’électrodes et d’électrolytes par le procédé A :
- Le composé de la cathode, de l’électrolyte et de l’anode est formé lors du traitement de l’électrode et de l’électrolyte.
- Une cellule élémentaire existe après le développement de l’électrode et de l’électrolyte.
- La caractéristique principale de la première chaîne de processus, la chaîne de processus A, est un processus d’extrusion continu dans lequel les couches sont formées puis laminées.
- Cette chaîne de processus est particulièrement bien adaptée aux matériaux entièrement solides à base de sulfure.
Production de cathodes et d’électrolytes (compoundage) :
- La méthode de production
- Deux industries de composition différentes utilisent des cathodes et des électrolytes fondus.
- Les composants du matériau sont introduits dans le cylindre chauffé d’une extrudeuse à double vis et peuvent être fournis sous forme de granulés ou de poudre.
- Les mouvements de rotation de l’extrudeuse transmettent l’énergie aux composants du matériau. Par conséquent, la masse fondue est homogène.
- Des particules d’électrolyte, qui réduisent la résistance entre la cathode et l’électrolyte, ainsi que des liants et des additifs, sont mélangés au contenu actif de la cathode.
- Les molécules d’électrolyte et les liants polymères sont deux éléments matériels de l’électrolyte.
Paramètres et conditions du processus :
- Quantité de matériaux individuels à fournir
- Température et pression dans le cylindre
- Le débit et la pression de l’extrudeuse
- Puissance de cisaillement
Caractéristiques de qualité :
- L’homogénéité de la masse fondue
- La viscosité de la masse fondue
- Amalgame entre échelle et quantité
Alternatives technologiques :
- Centrale de mélange à haute performance
Production de cathodes et d’électrolytes (co-extrusion) :
- La méthode de production
- Dans une filière appropriée, les masses fondues de la cathode et de l’électrolyte sont co-extrudées. On obtient ainsi une combinaison de couches de cathode et d’électrolyte.
- Des canaux séparés alimentent la cathode, et l’électrolyte fond à travers la filière d’extrusion.
- Les masses fondues traversent les canaux jusqu’à la sortie de la filière d’extrusion. Les masses fondues sont extrudées sur un conducteur de courant à l’aide d’une filière à fente.
Paramètres et exigences du processus :
- Réglage de l’épaisseur de la couche
- Vitesse d’alimentation en matière fondue
- Température
- Pression
- Vitesse du rouleau
- Pression de pressage du rouleau de la calandre
Caractéristiques de qualité :
- Épaisseur du revêtement
- Largeur de la couche
- Adhésion entre les couches
Alternatives technologiques :
- Sérigraphie
Coulée de feuilles
Production d’anodes (extrusion et calandrage) :
- Une anode entièrement SSB peut être constituée d’une feuille de lithium métallique. L’extrusion suivie d’un calandrage peut être utilisée pour fabriquer ce film de lithium.
- Le lithium liquide est versé à cet effet dans le cylindre d’une extrudeuse à piston. Le lithium est ensuite pressé dans une buse par un piston.
- Le calandrage après l’extrusion assure l’homogénéité et l’épaisseur du film optique. Le film est enroulé sous tension par deux rouleaux avec l’application d’un lubrifiant pour cette raison.
- Les rouleaux doivent être capables de travailler avec l’adhésivité du lithium. Les rouleaux à revêtement polymère, tels que ceux fabriqués en polyacétal, y parviendront.
Paramètres et exigences du processus :
- Vitesse d’extrusion
- Température
- Géométrie de la buse
- Pression des rouleaux de calendrier
- Vitesse d’alimentation du lubrifiant
- Vitesse du rouleau
Caractéristiques de qualité :
- Épaisseur du film
- Largeur de la feuille
- Homogénéité de la feuille de lithium
Alternatives technologiques :
- Dépôt de couches atomiques
Procédé PVD
Production de composés de couches (laminage) :
- Une feuille de lithium est laminée sur le composite cathode-électrolyte après son traitement. Pour cette tâche, les deux couches sont placées ensemble à l’aide de rouleaux.
- Deux rouleaux sont utilisés pour forcer les deux couches ensemble lors de l’étape suivante. Pour obtenir des forces d’adhésion plus importantes, on les chauffe. Les polymères pénètrent d’une couche à l’autre pendant le chauffage et le pressage, créant ainsi le lien entre l’anode et l’électrolyte.
- On peut distinguer le pelliculage « à sec » et le pelliculage « humide ». Jusqu’au laminage, le laminage humide humidifie les surfaces de contact avec un solvant. Cela facilite le laminage à basse température et à basse pression.
Paramètres et exigences du processus :
- Vitesse d’alimentation des couches
- Vitesse du rouleau
- Pression
- Chauffage facultatif des couches
Caractéristiques de qualité :
- Adhésion entre les couches
- Épaisseur souhaitée du composite
- La géométrie du composite
Alternatives technologiques :
- Pressage et frittage ultérieur
Procédé de production d’électrodes et d’électrolytes B
- Le processus de dépôt physique en phase vapeur (PVD), dans lequel les différentes couches sont ajoutées les unes après les autres, est la caractéristique clé de la chaîne de procédure B illustrée ci-dessous.
- Ce procédé actuel, qui présente les étapes de fabrication d’une batterie en couche mince, est particulièrement adapté aux batteries tout-solides à base d’oxyde.
Préparation des matériaux (broyage et mélange) :
- Méthodologie de fabrication
- Un broyeur à boulets est utilisé pour isoler la poudre de cathode de la poudre d’électrolyte.
- Pour cette tâche, les matières premières sont placées dans un tambour de broyage cylindrique. Les boules sont utilisées comme support de broyage dans ce tambour de broyage.
- Les mouvements de rotation du cylindre combinent les matériaux de départ. En outre, le mouvement de rotation garantit que le milieu de broyage et le matériau de départ se déplacent l’un par rapport à l’autre lors du broyage de ce dernier.
- Ensuite, la poudre est calcinée pour obtenir les propriétés souhaitées de la poudre.
Exigences et paramètres du processus :
- Matériau des billes
- Vitesse
- Temps de broyage
- Matériau du cylindre
- Quantité de matière première
Caractéristiques de qualité :
- Taille moyenne des particules de poudre
- Homogénéité de la poudre (degré de mélange)
Alternatives technologiques :
- Procédé sol-gel
Production de composés en couches (pulvérisation à haute fréquence) :
Procédé de fabrication :
- La pulvérisation à haute fréquence est utilisée pour créer les couches de cathode et d’électrolyte à partir de poudres de cathode et d’électrolyte. Le but du processus de pulvérisation est d’abord fabriqué à partir de poudres à l’aide d’une matrice ou d’un système de pressage à chaud.
- Le présent collecteur sert également de substrat au processus. La couche cathodique est déposée dans la première phase. Une couche d’électrolyte est ensuite placée sur la couche de la cathode.
- Les ions sont dirigés vers la cible de l’opération de pulvérisation. Au cours de cette étape, les atomes sont éliminés de la cible, qui passe ensuite en phase gazeuse et avance vers le substrat. La couche est donc développée atome par atome à la surface du substrat.
- Une chambre à vide est utilisée pour la pulvérisation à haute fréquence.
Exigences et paramètres du processus :
- Température
- Temps de dépôt
- Pression du processus
- Atmosphère ambiante
- Puissance du processus/densité de puissance
- Diamètre de la cible et distance de la cible
Caractéristiques de qualité :
- L’épaisseur de la couche du collecteur de courant
- L’épaisseur de la couche de la cathode et de l’électrolyte
Alternatives technologiques :
- Dépôt chimique en phase vapeur
Dépôt de composés en couches (frittage)
Procédé de fabrication :
- Les couches de cathode et d’électrolyte sont comprimées pendant le frittage. En renforçant la liaison entre les deux couches, la résistance à l’interface électrolyte-électrode peut être réduite.
- Un four de frittage est utilisé pour fritter le composé cathode-électrolyte. La substance est chauffée juste en dessous de son point de fusion.
- La porosité résultante des matériaux peut être modifiée en fonction des paramètres du processus choisis.
- Pour éviter toute réaction avec l’environnement, le processus de frittage se déroule dans une atmosphère inerte ou sous vide.
- Le frittage est particulièrement critique pour les électrolytes solides à base d’oxydes afin d’obtenir une tolérance interfaciale suffisamment faible.
Production de composés en couches (évaporation thermique) :
Processus de production :
- L’anode peut être appliquée sur le composé cathode-électrolyte par évaporation thermique. Le contenu de l’anode est constitué de lithium métallique.
- L’évaporation thermique nécessite de chauffer le lithium métallique à des températures supérieures au point d’ébullition, par exemple avec un évaporateur à faisceau d’électrons, afin qu’il puisse atteindre la phase vapeur. Dans la chambre à vide, la vapeur se répand uniformément.
- La condensation forme le revêtement sur la surface de l’électrolyte à basse température.
- L’évaporation thermique se fait dans une chambre à vide, comparable à la pulvérisation cathodique.